Autor:
Louise Ward
Data E Krijimit:
11 Shkurt 2021
Datën E Azhurnimit:
1 Korrik 2024

Përmbajtje
Madhësia e një atomi është aq e vogël sa është e vështirë të matësh me saktësi numrin atomik të një përbërje kimike. Për të qenë në gjendje të matin me saktësi një sasi të substancave, shkencëtarët përdorin një njësi të moleve për të përfaqësuar një numër të caktuar të atomeve. Një mol i substancës është përcaktuar të jetë ekuivalente me numrin e atomeve të karbonit që përmbahen në 12 gram izotop karboni, që është rreth 6,022 x 10 atome. Kjo vlerë quhet numri Avogadro, ose konstanta Avogadro. Kjo është referuar gjithashtu si numri i atomeve në 1 mol të çdo elementi, dhe 1 mol të masës së një substance quhet masë molare e asaj substance.
Hapat
Metoda 1 nga 2: Llogaritni masën molare të një elementi
Përkufizimi i masës molare. Masa molare e një substance është masa (në gram) e një moli të asaj substance. Për të llogaritur masën molare të një elementi, shumëzoni masën e tij atomike me faktorin e konvertimit gram për mol (g / mol).
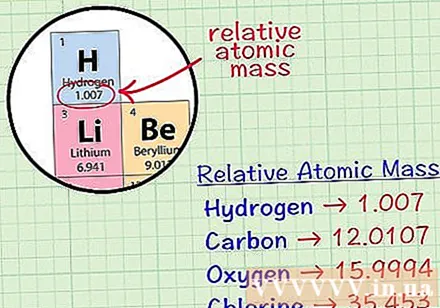
Gjeni atomin mesatar kub të një elementi. Atomi mesatar i masës së një elementi është masa mesatare, në njësitë atomike, në një mostër që përfshin të gjithë izotopet e këtij elementi. Ky informacion shpesh jepet në sistemin periodik të elementeve. Duke lokalizuar një element, ju mund të gjeni një atom kub mesatar të shkruar pak më poshtë se simboli kimik i elementit. Kjo vlerë nuk është një numër i plotë, por një numër me presje dhjetore.- Për shembull, me hidrogjen, atomi mesatar i masës është 1.007; Atomi kub mesatar i karbonit është 12,0107; Atomi mesatar i masës së oksigjenit është 15,9994; klori ka një masë mesatare atomike prej 35,453.

Shumëzoni atomin mesatar të masës me konstantën e masës molare. Njësia e rrëshqitjes molare përcaktohet si 0.001 kilogram për mol, ose 1 gram për mol. Produkti i atomit mesatar të masës dhe konstantës së masës molare shndërron njësinë e masës atomike në gram për mol, kështu që masa molare e hidrogjenit do të jetë 1.007 gram për mol, për karbonin është 12. , 0107 gram për mol, oksigjen është 15,9995 gram për mol, dhe ai i klorit është 35,453 gram për mol.- Disa elementë ekzistojnë në natyrë si molekula që përbëhen nga dy ose më shumë atome të njëjta. Kjo është, nëse doni të llogaritni masën molare të përbërjeve të përbërë nga më shumë se një atom, të tilla si gazi hidrogjen, gazi i oksigjenit ose gazi i klorit, duhet të përcaktoni masën mesatare atomike të përbërjes dhe ta shumëzoni këtë vlerë. me konstantën e masës molare, '' atëherë '' shumëzoni produktin që sapo gjetët me 2.
- Me H2: 1,007 x 2 = 2,014 gram për mol; për O2: 15,9994 x 2 = 31,9988 gram për mol; dhe Cl2: 35,453 x 2 = 70,096 gram për mol.
Metoda 2 e 2: Llogaritni masën molare të përbërjes

Përcaktoni formulën strukturore të përbërjes. Formula strukturore e një substance jep numrin atomik të secilit element që e përbën atë përbërje. (Ky informacion është në dispozicion në të gjithë librat e referencës). Për shembull, formula kimike e acidit klorhidrik është HCl; e glukozës është C6H12O6. Me këtë formulë strukturore, ne mund të përcaktojmë numrin e secilit lloj të atomit që përbën përbërjen në shqyrtim.- Ku HCl ka një atom hidrogjeni dhe një atom klor.
- Molekula e sheqerit të glukozës C6H12O6 ka 6 atome karboni, 12 atome hidrogjeni dhe 6 atome oksigjeni.
Përcaktoni atomin mesatar të masës së secilit element përbërës. Përdorni tabelën periodike për të gjetur atomin mesatar të masës të secilit element të pranishëm në përbërje. Atomi mesatar i masës zakonisht shkruhet nën simbolin kimik të elementit në sistemin periodik. Ngjashëm me llogaritjen e masës molare të një elementi, shumëzoni atomin mesatar të masës me 1 gram / mol.
- Atomi mesatar i masës së elementeve që formojnë acid klorhidrik është si më poshtë: hidrogjen 1,007 g / mol dhe klor 35,453 g / mol.
- Atomi mesatar i masës së elementeve që përbëjnë molekulën e glukozës janë: karboni, 12,017 g / mol; hidrogjen, 1,007 g / mol; dhe oksigjen, 15,9995 g / mol.
Llogaritni masën molare të secilit element përbërës. Shumëzimi i atomit të masës së një elementi me numrin e atomeve që kontribuon në një përbërje jep masën mesatare të elementit në përbërje.
- Në rastin e acidit klorhidrik, acidit klorhidrik, masa molare e elementit hidrogjen është 1,007 g / mol, dhe ajo e klorit është 35,453 g / mol.
- Në rastin e glukozës, C6H12O6, masa molare e secilit element është si vijon: karboni, 12,0107 x 6 = 72,0642 g / mol; hidrogjen, 1,007 x 12 = 12,084 g / mol; oksigjen, 15,9995 x 6 = 95,9964 g / mol.
Masa molare totale e elementeve përbërëse. Masa molare totale e elementeve të kompostimit është masa molare e përbërjes.Në hapin e mëparshëm kemi llogaritur masën molare të secilit element të pranishëm në përbërje, në këtë hap duhet vetëm të shtojmë të gjitha këto vlera së bashku.
- Masa molare e acidit klorhidrik është 1,007 + 35,453 = 36,460 g / mol. 36,46 gram është masa e 1 mol acid klorhidrik.
- Masa molare e glukozës është 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. Pra, çdo mol glukozë ka një masë prej 180.14 gram.
Këshilla
- Megjithëse në shumicën e rasteve atomi mesatar i masës regjistrohet në 1 pjesë më të afërt 1000 (4 presje dhjetore), në laboratorë, masa molare shpesh zvogëlohet në 2 dhjetore, ndonjëherë edhe më pak, për molekulat e mëdha. Prandaj, në rastin laboratorik, masa molare e acidit klorhidrik mund të shkruhet si 36,46 gram për mol, për glukozën 180,14 gram për mol.
Çfarë ju duhet
- Libri kimik i referencës ose tabela periodike e elementeve
- Kompjuter