Autor:
Helen Garcia
Data E Krijimit:
17 Prill 2021
Datën E Azhurnimit:
1 Korrik 2024
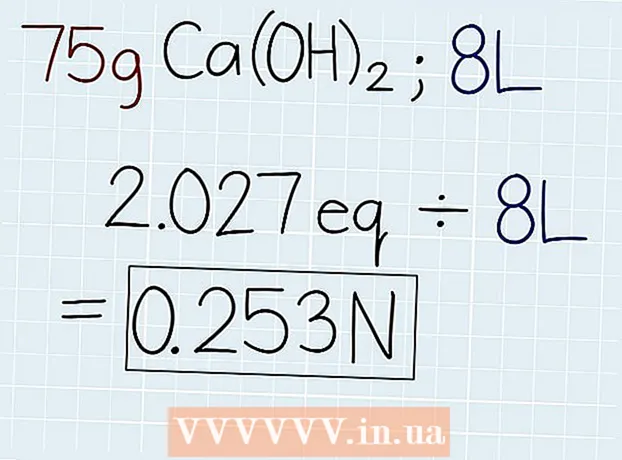
Përmbajtje
- Hapa
- Metoda 1 nga 2: Llogaritja e Normalitetit përmes Molaritetit
- Metoda 2 nga 2: Llogaritja e Normalitetit në Masën Ekuivalente
- Këshilla
- Cfare te nevojitet
Normaliteti tregon përqendrimin e acidit ose alkali në një zgjidhje. Për të zbuluar normalitetin e një zgjidhjeje, molariteti dhe masa ekuivalente e molekulës mund të përdoren në llogaritjet. Nëse zgjidhni të përdorni molaritetin, përdorni formulën N = M (n), ku M është molariteti dhe n është numri i molekulave të hidrogjenit ose hidroksidit. Nëse vendosni të përdorni masën ekuivalente, përdorni formulën N = eq ÷ V, ku eq është numri i ekuivalentëve dhe V është vëllimi i zgjidhjes.
Hapa
Metoda 1 nga 2: Llogaritja e Normalitetit përmes Molaritetit
 1 Shtoni masën molare të të gjithë përbërësve të tretësirës. Gjeni elementët e formulës kimike në tabelën periodike për të gjetur masën e tyre atomike, e cila korrespondon me masën molare. Shkruani masën molare të secilit element dhe shumëzojeni atë me numrin e atyre elementeve. Shtoni masën molare të të gjithë përbërësve për të gjetur masën molare totale.
1 Shtoni masën molare të të gjithë përbërësve të tretësirës. Gjeni elementët e formulës kimike në tabelën periodike për të gjetur masën e tyre atomike, e cila korrespondon me masën molare. Shkruani masën molare të secilit element dhe shumëzojeni atë me numrin e atyre elementeve. Shtoni masën molare të të gjithë përbërësve për të gjetur masën molare totale. - Për shembull, nëse doni të dini masën molare të acidit sulfurik (H2KËSHTU QË4), zbuloni masën molare të hidrogjenit (1 g), squfurit (3 g) dhe oksigjenit (16 g).
- Shumëzoni masën me numrin e përbërësve në përbërje. Në shembullin tonë, ka 2 atome hidrogjeni dhe 4 atome oksigjeni. Masa molare totale e hidrogjenit është 2 x 1 g = 2 g. Masa molare e oksigjenit në këtë tretësirë do të jetë 4 x 16 g = 64 g.
- Shtoni të gjitha masat molare së bashku. Ju merrni 2 g + 32 g + 64 g = 98 g / mol.
- Nëse e dini tashmë molaritetin e zgjidhjes që po kërkoni, shkoni direkt në Hapin 4.
 2 Ndani masën aktuale të tretësirës me masën molare. Gjeni peshën aktuale të zgjidhjes. Do të tregohet ose në enën me zgjidhjen, ose në vetë detyrën.Pastaj ndajeni masën e tretësirës me masën molare totale të gjetur më herët. Rezultati do të jetë numri i nishaneve në tretësirë, pas së cilës duhet të shkruhet "nishani".
2 Ndani masën aktuale të tretësirës me masën molare. Gjeni peshën aktuale të zgjidhjes. Do të tregohet ose në enën me zgjidhjen, ose në vetë detyrën.Pastaj ndajeni masën e tretësirës me masën molare totale të gjetur më herët. Rezultati do të jetë numri i nishaneve në tretësirë, pas së cilës duhet të shkruhet "nishani". - Për shembull, nëse po përpiqeni të zbuloni normalitetin e 100 g H2KËSHTU QË4tretur në 12 litra lëng, përdorni masën aktuale dhe ndani me molar. Si rezultat, ju do të merrni: 100 g ÷ 98 g / mol = 1.02 mol.
- 1 mol është e barabartë me 6.02 x 10 atome ose molekula të një zgjidhjeje.
 3 Ndani rezultatin me vëllimin e tretësirës në litra për të gjetur molaritetin. Merrni numrin e nishaneve në tretësirën e sapo llogaritur dhe ndajeni atë me vëllimin e përgjithshëm të tretësirës që do të matet. Si rezultat, do të njihni molaritetin (M), me të cilin mund të zbuloni përqendrimin e zgjidhjes.
3 Ndani rezultatin me vëllimin e tretësirës në litra për të gjetur molaritetin. Merrni numrin e nishaneve në tretësirën e sapo llogaritur dhe ndajeni atë me vëllimin e përgjithshëm të tretësirës që do të matet. Si rezultat, do të njihni molaritetin (M), me të cilin mund të zbuloni përqendrimin e zgjidhjes. - Bazuar në shembullin tonë, marrim formulën e mëposhtme: 1.02 mol ÷ 12 L = 0.085 M.
Këshilla: sigurohuni që të konvertoni vëllimin e zgjidhjes në litra, nëse nuk e keni bërë tashmë këtë. Përndryshe, do të merrni përgjigjen e gabuar.
 4 Shumëzoni molaritetin me numrin e molekulave të hidrogjenit ose hidroksidit. Hidhini një sy formulës kimike për të gjetur numrin e atomeve të hidrogjenit (H) në një molekulë acidi ose hidroksidi në (OH) në bazë. Pastaj shumëzoni molaritetin e tretësirës me numrin e molekulave të hidrogjenit ose hidroksidit në atë zgjidhje për të gjetur përqendrimin normal, ose normalitetin. Në fund të përgjigjes suaj, shkruani shkurtesën "N".
4 Shumëzoni molaritetin me numrin e molekulave të hidrogjenit ose hidroksidit. Hidhini një sy formulës kimike për të gjetur numrin e atomeve të hidrogjenit (H) në një molekulë acidi ose hidroksidi në (OH) në bazë. Pastaj shumëzoni molaritetin e tretësirës me numrin e molekulave të hidrogjenit ose hidroksidit në atë zgjidhje për të gjetur përqendrimin normal, ose normalitetin. Në fund të përgjigjes suaj, shkruani shkurtesën "N". - Në shembullin tonë, acidi sulfurik (H2KËSHTU QË4) 2 atome hidrogjeni. Pra formula do të jetë kështu: 0.085 M x 2 = 0.17 N.
- Në një shembull tjetër, hidroksidi i natriumit (NaOH) me një molaritet prej 2 M ka vetëm 1 molekulë hidroksid. Prandaj, formula do të jetë si më poshtë: 2 M x 1 = 2 N.
Metoda 2 nga 2: Llogaritja e Normalitetit në Masën Ekuivalente
 1 Gjeni masën molare totale të tretësirës. Hidhini një sy formulës kimike të zgjidhjes dhe gjeni secilin element në tabelën periodike. Shkruani masën molare të secilit element dhe shumëzojeni atë me numrin e atyre elementeve në formulë. Shtoni të gjitha masat molare së bashku për të gjetur masën molare totale në gram.
1 Gjeni masën molare totale të tretësirës. Hidhini një sy formulës kimike të zgjidhjes dhe gjeni secilin element në tabelën periodike. Shkruani masën molare të secilit element dhe shumëzojeni atë me numrin e atyre elementeve në formulë. Shtoni të gjitha masat molare së bashku për të gjetur masën molare totale në gram. - Për shembull, nëse doni të dini masën molare të Ca (OH)2, atëherë zbuloni masën molare të kalciumit (40 g), oksigjenit (16 g) dhe hidrogjenit (1 g).
- Në formulë ka 2 atome oksigjeni dhe hidrogjeni. Masa totale e oksigjenit do të jetë: 2 x 16 g = 32 g. Masa molare e hidrogjenit do të jetë: 2 x 1 g = 2 g.
- Shtoni të gjitha masat molare së bashku për të marrë 40 g + 32 g + 2 g = 74 g / mol.
 2 Ndani masën molare me numrin e molekulave të hidrogjenit ose hidroksidit. Gjeni numrin e atomeve të hidrogjenit (H) në molekulat e acidit ose hidroksidit (OH) në bazë. Ndani masën molare totale të marrë vetëm me numrin e atomeve ose molekulave për të gjetur peshën e 1 ekuivalenti, e cila do të jetë e barabartë me masën e 1 mole hidrogjeni ose hidroksidi. Në fund të përgjigjes, shkruani shkurtimin "G.-e." që do të thotë masa e ekuivalentit.
2 Ndani masën molare me numrin e molekulave të hidrogjenit ose hidroksidit. Gjeni numrin e atomeve të hidrogjenit (H) në molekulat e acidit ose hidroksidit (OH) në bazë. Ndani masën molare totale të marrë vetëm me numrin e atomeve ose molekulave për të gjetur peshën e 1 ekuivalenti, e cila do të jetë e barabartë me masën e 1 mole hidrogjeni ose hidroksidi. Në fund të përgjigjes, shkruani shkurtimin "G.-e." që do të thotë masa e ekuivalentit. - Në shembullin tonë, Ca (OH)2 2 dy molekula hidrogjeni, që do të thotë se masa ekuivalente do të jetë e barabartë me 74 g / mol ÷ 2 = 37 G.-e.
 3 Ndani peshën aktuale të tretësirës me peshën ekuivalente. Pasi ta njihni masën e ekuivalentit, ndajeni atë me masën e tretësirës, e cila tregohet në enën me tretësirë ose në problemin që zgjidhet. Përgjigja do të jetë numri i ekuivalentëve në zgjidhje, në mënyrë që të llogaritni normalitetin. Në fund të përgjigjes, vendosni shkurtesën "e".
3 Ndani peshën aktuale të tretësirës me peshën ekuivalente. Pasi ta njihni masën e ekuivalentit, ndajeni atë me masën e tretësirës, e cila tregohet në enën me tretësirë ose në problemin që zgjidhet. Përgjigja do të jetë numri i ekuivalentëve në zgjidhje, në mënyrë që të llogaritni normalitetin. Në fund të përgjigjes, vendosni shkurtesën "e". - Nëse në shembullin tonë 75 g Ca (OH)2, atëherë formula do të jetë si më poshtë: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 Pjestoni numrin e ekuivalentëve me vëllimin e tretësirës në litra. Gjeni vëllimin e përgjithshëm të zgjidhjes dhe shkruani përgjigjen në litra. Merrni numrin e ekuivalentëve të sapo marrë dhe ndani me vëllimin e zgjidhjes për të gjetur normalitetin. Në fund të përgjigjes suaj vendosni një shkurtim "N".
4 Pjestoni numrin e ekuivalentëve me vëllimin e tretësirës në litra. Gjeni vëllimin e përgjithshëm të zgjidhjes dhe shkruani përgjigjen në litra. Merrni numrin e ekuivalentëve të sapo marrë dhe ndani me vëllimin e zgjidhjes për të gjetur normalitetin. Në fund të përgjigjes suaj vendosni një shkurtim "N". - Nëse ka 75 g Ca (OH) në një tretësirë me vëllim 8 litra2, atëherë ndani numrin e ekuivalentëve me vëllimin në mënyrën e mëposhtme: 2.027 Oe. ÷ 8 l = 0.253 N.
Këshilla
- Përqendrimi normal, ose normaliteti, përdoret zakonisht për të matur acidet dhe bazat. Nëse keni nevojë të përcaktoni përqendrimin e një zgjidhjeje tjetër, kjo zakonisht bëhet duke matur molaritetin.
Cfare te nevojitet
- Tabelë periodike
- Kalkulator



