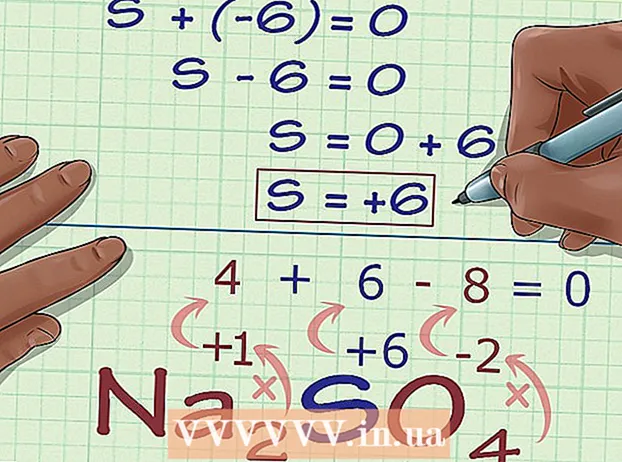
Përmbajtje
- Të shkelësh
- Pjesa 1 nga 2: Caktimi i numrave të oksidimit bazuar në rregullat kimike
- Pjesa 2 nga 2: Caktimi i numrave atomeve pa rregullat për numrat e oksidimit
- Këshilla
- Nevojat
Në kimi, termat "oksidim" dhe "zvogëlim" nënkuptojnë ato reaksione në të cilat një atom (ose një grup atomesh) humbet ose fiton elektron, respektivisht. Numrat e oksidimit janë numra të caktuar atomeve (ose grupeve të atomeve) për të ndihmuar kimistët në kontrollimin e sa elektroneve janë në dispozicion për t'u zhvendosur dhe nëse reaksionet e dhëna oksidohen ose zvogëlohen gjatë një reagimi. Procesi i caktimit të numrave të oksidimit tek atomet mund të shkojë nga shumë e thjeshtë në më komplekse, në varësi të ngarkesës së atomeve dhe përbërjes kimike të molekulave, pjesë e të cilave janë. Për t'i bërë gjërat më të komplikuara, disa atome mund të kenë numra të shumtë të oksidimit. Për fat të mirë, caktimi i numrave të oksidimit drejtohet nga rregulla të përcaktuara qartë, të lehta për tu ndjekur, por një kuptim themelor i kimisë dhe algjebrës do ta bëjë përdorimin e këtyre rregullave shumë më të lehtë.
Të shkelësh
Pjesa 1 nga 2: Caktimi i numrave të oksidimit bazuar në rregullat kimike
 Përcaktoni nëse substanca në fjalë është elementare. Atomet e lira, të palidhura kanë gjithmonë një numër oksidimi prej 0. Kjo është e vërtetë për të dy atomet që përbëhen nga një atom të vetëm dhe atomet forma elementare e të cilëve është diatomike ose poliatonike.
Përcaktoni nëse substanca në fjalë është elementare. Atomet e lira, të palidhura kanë gjithmonë një numër oksidimi prej 0. Kjo është e vërtetë për të dy atomet që përbëhen nga një atom të vetëm dhe atomet forma elementare e të cilëve është diatomike ose poliatonike. - Për shembull, Al(s) dhe Cl2 të dy kanë numrin e oksidimit 0 sepse nuk janë atome të përbëra.
- Vini re se squfuri në formën e tij elementare, S.8 (oktasulfuri), megjithëse i parregullt, ka gjithashtu një numër oksidimi 0.
 Përcaktoni nëse substanca në fjalë është një jon. Jonet kanë numra oksidimi të barabartë me ngarkesën e tyre. Kjo është e vërtetë për jonet e palidhura, si dhe jonet që janë pjesë e një joni të përbërë.
Përcaktoni nëse substanca në fjalë është një jon. Jonet kanë numra oksidimi të barabartë me ngarkesën e tyre. Kjo është e vërtetë për jonet e palidhura, si dhe jonet që janë pjesë e një joni të përbërë. - Për shembull, joni Cl ka një numër oksidimi prej -1.
- Joni Cl akoma ka një numër oksidimi prej -1 kur është pjesë e përbërësit NaCl. Meqenëse joni Na, sipas përkufizimit, ka një ngarkesë prej +1, ne e dimë që joni Cl ka një ngarkesë prej -1, kështu që numri i oksidimit është akoma -1.
 Në rastin e joneve metalike, është mirë të mbani mend se numrat e shumëfishtë të oksidimit janë të mundshëm. Shumë metale mund të kenë më shumë se një ulje. Për shembull, hekuri metalik (Fe) mund të jetë një jon me ngarkesë +2 ose +3. ngarkesa e joneve metalike (dhe kështu numrat e tyre të oksidimit) mund të përcaktohet në lidhje me ngarkesën e atomeve të tjerë në përbërjen e të cilave ata janë pjesë, ose, kur shkruhet si tekst, nga shënimi në numrat romakë (të tilla si në fjalia: "Joni i hekurit (III) ka një ngarkesë +3.").
Në rastin e joneve metalike, është mirë të mbani mend se numrat e shumëfishtë të oksidimit janë të mundshëm. Shumë metale mund të kenë më shumë se një ulje. Për shembull, hekuri metalik (Fe) mund të jetë një jon me ngarkesë +2 ose +3. ngarkesa e joneve metalike (dhe kështu numrat e tyre të oksidimit) mund të përcaktohet në lidhje me ngarkesën e atomeve të tjerë në përbërjen e të cilave ata janë pjesë, ose, kur shkruhet si tekst, nga shënimi në numrat romakë (të tilla si në fjalia: "Joni i hekurit (III) ka një ngarkesë +3."). - Për shembull, le të shohim nga afër një përbërje që përmban një jon alumini. Përbërja AlCl3 ka një ngarkesë prej 0. Për shkak se ne e dimë që jonet Cl kanë një ngarkesë prej -1 dhe 3 jone Cl janë të pranishme në përbërje, joni Al duhet të ketë një ngarkesë prej +3, në mënyrë që ngarkesa e të gjithë joneve të bashkuara të jetë 0 Pra, numri i oksidimit të Al është +3.
 Caktoni një numër oksidimi -2 në oksigjen (me përjashtime). Në pothuajse në të gjitha rastet, atomet e oksigjenit kanë një numër oksidimi -2. Ekzistojnë disa përjashtime nga ky rregull:
Caktoni një numër oksidimi -2 në oksigjen (me përjashtime). Në pothuajse në të gjitha rastet, atomet e oksigjenit kanë një numër oksidimi -2. Ekzistojnë disa përjashtime nga ky rregull: - Kur oksigjeni është në gjendje elementare (O2), atëherë numri i oksidimit është i barabartë me 0, që është rasti për të gjithë atomet elementarë.
- Kur oksigjeni është pjesë e peroksid, atëherë numri i oksidimit është -1. Peroksidet janë një klasë përbërjesh që kanë një lidhje oksigjen-oksigjen (ose anionin peroksid O2) Për shembull, në molekulën H2O2 (peroksid hidrogjeni), oksigjeni ka një numër oksidimi (dhe një ngarkesë) prej -1.Po ashtu, kur oksigjeni është pjesë e një superoksidi, numri i oksidimit është -0,5.
- Kur oksigjeni lidhet me fluorin, numri i oksidimit është +2. Shihni rregullin e fluorit më poshtë për më shumë informacion. Në (O2F.2) kjo është +1.
 Caktoni një numër oksidimi prej +1 hidrogjenit (me përjashtime). Ashtu si me oksigjenin, numri i oksidimit të hidrogjenit varet nga raste të jashtëzakonshme. Në përgjithësi, hidrogjeni ka një numër oksidimi +1 (përveç në formën elementare, H.2) Por në rastin e një përbërje të veçantë të quajtur hibride, hidrogjeni ka një numër oksidimi prej -1.
Caktoni një numër oksidimi prej +1 hidrogjenit (me përjashtime). Ashtu si me oksigjenin, numri i oksidimit të hidrogjenit varet nga raste të jashtëzakonshme. Në përgjithësi, hidrogjeni ka një numër oksidimi +1 (përveç në formën elementare, H.2) Por në rastin e një përbërje të veçantë të quajtur hibride, hidrogjeni ka një numër oksidimi prej -1. - Për shembull, nga H2Oh, ne e dimë që hidrogjeni ka një numër oksidimi +1 sepse oksigjeni ka një ngarkesë -2 dhe na duhen 2 +1 ngarkesa për të bërë një përbërje me një ngarkesë totale zero. Por me substancën hidrid natriumi, NaH, hidrogjeni ka një numër oksidimi -1 sepse joni Na ka një ngarkesë prej +1 dhe, për të bërë ngarkesën totale të përbërjes 0, hidrogjeni ka një ngarkesë (dhe kështu një numër oksidimi) të -1
 Fluori gjithmone një numër oksidimi prej -1. Siç tregohet më sipër, numrat e oksidimit të elementeve të caktuara mund të ndryshojnë për shkak të faktorëve të ndryshëm (jonet e metaleve, atomet e oksigjenit në perokside, etj.). Nga ana tjetër, fluori ka një numër oksidimi -1, dhe ai kurrë nuk ndryshon. Kjo sepse fluori është elementi më elektro-negativ, ose me fjalë të tjera, është elementi që është më pak i gatshëm të heqë dorë nga elektronet dhe ka shumë të ngjarë të marrë elektrone nga atomet e tjerë. Prandaj, numri i oksidimit nuk do të ndryshojë.
Fluori gjithmone një numër oksidimi prej -1. Siç tregohet më sipër, numrat e oksidimit të elementeve të caktuara mund të ndryshojnë për shkak të faktorëve të ndryshëm (jonet e metaleve, atomet e oksigjenit në perokside, etj.). Nga ana tjetër, fluori ka një numër oksidimi -1, dhe ai kurrë nuk ndryshon. Kjo sepse fluori është elementi më elektro-negativ, ose me fjalë të tjera, është elementi që është më pak i gatshëm të heqë dorë nga elektronet dhe ka shumë të ngjarë të marrë elektrone nga atomet e tjerë. Prandaj, numri i oksidimit nuk do të ndryshojë.  Numrat e oksidimit në një përbërje janë të barabartë me ngarkesën e përbërjes. Numrat e oksidimit të të gjithë atomeve në një përbërje janë të barabartë me ngarkesën e asaj përbërjeje. Për shembull, nëse një përbërje nuk ka ngarkesë, atëherë shuma e të gjithë numrave të oksidimit do të jetë zero; nëse përbërja është një jon poliatomik me ngarkesë -1, atëherë numrat e oksidimit të shtuar duhet të jenë -1, etj.
Numrat e oksidimit në një përbërje janë të barabartë me ngarkesën e përbërjes. Numrat e oksidimit të të gjithë atomeve në një përbërje janë të barabartë me ngarkesën e asaj përbërjeje. Për shembull, nëse një përbërje nuk ka ngarkesë, atëherë shuma e të gjithë numrave të oksidimit do të jetë zero; nëse përbërja është një jon poliatomik me ngarkesë -1, atëherë numrat e oksidimit të shtuar duhet të jenë -1, etj. - Kjo është një mënyrë e mirë për të kontrolluar përgjigjen tuaj - nëse numrat e shtuar të oksidimit të një përbërjeje nuk barazojnë ngarkesën e asaj përbërjeje, atëherë e dini që keni bërë një gabim.
Pjesa 2 nga 2: Caktimi i numrave atomeve pa rregullat për numrat e oksidimit
 Gjeni atome pa rregulla të numrit të oksidimit. Disa atome nuk ndjekin rregullat për gjetjen e numrave të oksidimit. Nëse një atom nuk përputhet me rregullat e mësipërme dhe nuk jeni i sigurt se cila është ngarkesa e tij (për shembull, nëse është pjesë e një përbërje më të madhe në mënyrë që ngarkesa individuale të mos jetë e njohur), ju mund të gjeni numrin e oksidimit të këtij atomi nga eleminimin. Së pari ju përcaktoni se cili është oksidimi i çdo atomi tjetër në përbërje. Pastaj zgjidh shumën për të panjohurën në ekuacion, bazuar në ngarkesën totale të përbërjes.
Gjeni atome pa rregulla të numrit të oksidimit. Disa atome nuk ndjekin rregullat për gjetjen e numrave të oksidimit. Nëse një atom nuk përputhet me rregullat e mësipërme dhe nuk jeni i sigurt se cila është ngarkesa e tij (për shembull, nëse është pjesë e një përbërje më të madhe në mënyrë që ngarkesa individuale të mos jetë e njohur), ju mund të gjeni numrin e oksidimit të këtij atomi nga eleminimin. Së pari ju përcaktoni se cili është oksidimi i çdo atomi tjetër në përbërje. Pastaj zgjidh shumën për të panjohurën në ekuacion, bazuar në ngarkesën totale të përbërjes. - Për shembull, në përbërjen Na2KËSHTU QË4, ngarkesa e squfurit (S) është e panjohur - nuk është në formën e tij elementare, kështu që nuk është 0, por kjo është gjithçka që dimë. Ky është një kandidat i mirë për zbatimin e kësaj metode për të përcaktuar numrin e oksidimit në mënyrë algjebrike.
 Përcaktoni numrat e njohur të oksidimit të elementeve të tjerë në përbërje. Duke përdorur rregullat e caktimit të numrit të oksidimit, ne përcaktojmë se cilët numra të oksidimit kanë atomet e tjerë në përbërje. Jini të vetëdijshëm për përjashtime të tilla si O, H, etj.
Përcaktoni numrat e njohur të oksidimit të elementeve të tjerë në përbërje. Duke përdorur rregullat e caktimit të numrit të oksidimit, ne përcaktojmë se cilët numra të oksidimit kanë atomet e tjerë në përbërje. Jini të vetëdijshëm për përjashtime të tilla si O, H, etj. - Në Na2KËSHTU QË4, ne e dimë, bazuar në grupin tonë të rregullave, se joni Na ka një ngarkesë (dhe kështu një numër oksidimi) prej +1 dhe se atomet e oksigjenit kanë numra oksidimi prej -2.
 Shumëzoni numrin e secilit atom me numrin e oksidimit. Tani që i dimë numrat e oksidimit të të gjithë atomeve përveç të panjohurës, do të duhet të konsiderojmë se disa prej këtyre atomeve mund të ndodhin më shumë se një herë. Shumëzoni çdo koeficient (të shkruar në nënshkrim pas simbolit të atomit në përbërje) me numrin e oksidimit.
Shumëzoni numrin e secilit atom me numrin e oksidimit. Tani që i dimë numrat e oksidimit të të gjithë atomeve përveç të panjohurës, do të duhet të konsiderojmë se disa prej këtyre atomeve mund të ndodhin më shumë se një herë. Shumëzoni çdo koeficient (të shkruar në nënshkrim pas simbolit të atomit në përbërje) me numrin e oksidimit. - Ndërsa Na2KËSHTU QË4, ne e dimë se ka 2 atome Na dhe 4 atome O. Tani bëjmë llogaritjen vijuese, 2 × +1, për të marrë numrin e oksidimit të Na, 2, dhe shumëzojmë 4 × -2, numrin e oksidimit të O, -8.
 Shtoni rezultatet. Shtimi i rezultateve të këtyre shumëzimeve jep numrin e oksidimit të përbërjes, pa duke marrë parasysh numrin e oksidimit të atomit të panjohur.
Shtoni rezultatet. Shtimi i rezultateve të këtyre shumëzimeve jep numrin e oksidimit të përbërjes, pa duke marrë parasysh numrin e oksidimit të atomit të panjohur. - Në shembullin tonë me Na2KËSHTU QË4, shtojmë 2 në -8 për të marrë -6.
 Llogaritni numrin e panjohur të oksidimit bazuar në ngarkesën e përbërjes. Tani i keni të gjitha të dhënat për të gjetur numrin e panjohur të oksidimit duke përdorur disa algjebër të thjeshtë. Ne do të përdorim një ekuacion dhe përgjigjen nga hapi i mëparshëm, plus ngarkesën e përbërjes. Me fjale te tjera: (Shuma e numrave të panjohur të oksidimit) + (numri i panjohur i oksidimit që dëshironi të dini) = (ngarkesa e përbërjes).
Llogaritni numrin e panjohur të oksidimit bazuar në ngarkesën e përbërjes. Tani i keni të gjitha të dhënat për të gjetur numrin e panjohur të oksidimit duke përdorur disa algjebër të thjeshtë. Ne do të përdorim një ekuacion dhe përgjigjen nga hapi i mëparshëm, plus ngarkesën e përbërjes. Me fjale te tjera: (Shuma e numrave të panjohur të oksidimit) + (numri i panjohur i oksidimit që dëshironi të dini) = (ngarkesa e përbërjes).- Në shembullin e Na2KËSHTU QË4, ne e zgjidhim këtë si më poshtë:
- (Shuma e numrave të njohur të oksidimit) + (numri i panjohur i oksidimit që dëshironi të zgjidhni) = (ngarkesa e përbërjes)
- -6 + S = 0
- S = 0 + 6
- S = 6. S ka një numër oksidimi ose 6 në Na2KËSHTU QË4.
- Në shembullin e Na2KËSHTU QË4, ne e zgjidhim këtë si më poshtë:
Këshilla
- Atomet në formën e tyre themelore kanë gjithmonë një numër oksidimi prej 0. Një jon që përbëhet nga 1 atom ka një numër oksidimi të barabartë me ngarkesën. Metalet e grupit 1A si hidrogjeni, litiumi dhe natriumi kanë një numër oksidimi +1; Metalet e grupit 2A, të tilla si magnezi dhe kalciumi, kanë një numër oksidimi prej +2. Si hidrogjeni ashtu edhe oksigjeni mund të kenë 2 numra të ndryshëm oksidimi, në varësi të lidhjes së tyre.
- Në një përbërje shuma e të gjithë numrave të oksidimit duhet të jetë e barabartë me 0. Nëse ekziston një jon me 2 atome, atëherë shuma e numrave të oksidimit duhet të jetë e barabartë me ngarkesën e jonit.
- Veryshtë shumë e dobishme të dini se si të lexoni tabelën periodike dhe ku të gjeni metalet dhe jometalet.
Nevojat
- Tabela periodike e elementeve
- Një lidhje interneti
- Një libër kimie
- Letër, stilolaps ose laps
- Llogaritësi