Autor:
Lewis Jackson
Data E Krijimit:
6 Mund 2021
Datën E Azhurnimit:
1 Korrik 2024
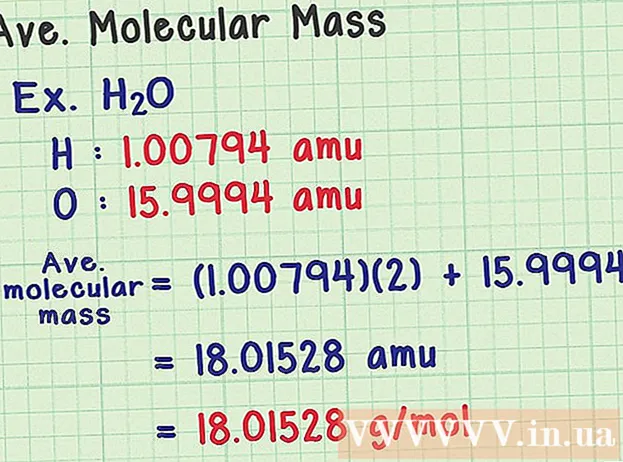
Përmbajtje
Atomi mesatar i masës nuk është një masë e drejtpërdrejtë e masës së një atomi. Në vend të kësaj, kjo është masa mesatare për atom nga një mostër tipike e elementit. Nëse mund të matni masat e miliarda atomeve individualë, mund ta zbuloni duke llogaritur mesataren e tyre. Ne kemi një metodë më praktike, e cila bazohet në informacionin në lidhje me izotopet e ndryshme të elementit kimik.
Hapat
Pjesa 1 nga 2: Llogaritni atomin mesatar të masës
Kuptoni izotopet dhe atomet e masës. Në natyrë, shumica e elementeve ekzistojnë në shumë forma ose izotope. I vetmi ndryshim midis dy izotopeve të të njëjtit element është numri i neutroneve në atom, numri i të cilëve të neutroneve ndikon në atomin e masës. Llogaritja e atomit mesatar të masës merr parasysh efektin e këtij ndryshimi dhe ju tregon masën mesatare të secilit atom në një mostër të atyre atomeve.
- Për shembull, elementi argjend (Ag) ka dy izotope natyrore: Ag-107 dhe Ag-109 (ose Ag dhe Ag). Izotopi është emëruar sipas "numrit të masës", ose shumës së numrit të protoneve dhe numrit të neutroneve në një atom. Kjo do të thotë që Ag-109 ka dy neutrone më shumë se Ag-107, kështu që atomi i tij është pak më i rëndë.

Gjeni masën e secilit izotop. Ju duhen dy informacione për secilin izotop, mund t'i kërkoni në librat e referencës ose të kërkoni në internet, për shembull webelement.com. E para është atomi i masës ose masa atomike e secilit izotop. Izotopet me më shumë neutrone kanë më shumë masë.- Për shembull, izotopi i argjendtë Ag-107 ka atom në masë 106.90509 amu (njësia e një atomi kub). Izotopi Ag-109 është pak më i rëndë me masë të 108,90470.
- Çifti i dhjetoreve në fund mund të jetë paksa i ndryshëm në dokumente. Mos shkruani asnjë numër në kllapa pas masës.

Shkruani shkallën natyrale të mbijetesës për secilin izotop. Ky raport tregon prevalencën e izotopit, si përqindje e atomeve totale të elementit. Këtë informacion mund ta gjeni në të njëjtin dokument me një atom kub mbi të. Mbijetesa natyrore e të gjithë izotopeve duhet të jetë 100% (megjithëse mund të ndryshojë pak për shkak të gabimit të rrumbullakosjes).- Izotopi Ag-107 ka raportin 51.86%. Izotopi Ag-109 është më pak i zakonshëm në shkallën prej 48,14%. Kjo do të thotë që një mostër normale argjendi ka 51.86% Ag-107 dhe 48.14% Ag-109.
- Çdo izotop pa këtë shkallë mbijetese injorohet. Këto izotope nuk ekzistojnë natyrshëm në tokë.

Shndërroni përqindjen e izotopit në një numër dhjetor. Ndarja e këtij raporti me 100 do të japë të njëjtën vlerë si një dhjetore.- Në mostrën e argjendit më lart, raporti i izotopeve është 51.86 / 100 = 0,5186 dhe 48,14 / 100 = 0,4814.
Gjeni atomin mesatar kub. Atomi mesatar i masës së një elementi ka n izotopet e barabartë (Blloku AtomikIzotopi 1 * raportIzotopi 1) + (masa atomikeIzotopi 2 * raportIzotopi 2) + ... + (masa atomikeizotopet n * raportizotopet n. Ky është një shembull i një "mase mesatare", që do të thotë se sa më e madhe të jetë shkalla e mbijetesës së izotopit, aq më i madh është efekti i tij në rezultat. Si të aplikoni këtë formulë për argjendin është si më poshtë:
- Atom me masë mesatareAg = (atom kubAg-107 * raportAg-107) + (masa atomikeAg-109 * raportAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107.8677 amu. - Gjeni atë element në tabelën periodike për të kontrolluar rezultatet. Atomi kub mesatar shkruhet gjithmonë nën simbolin kimik të elementit.
- Atom me masë mesatareAg = (atom kubAg-107 * raportAg-107) + (masa atomikeAg-109 * raportAg-109)
Pjesa 2 nga 2: Përdorimi i rezultateve
Shndërroni masën në numër atomik. Atomi mesatar i masës tregon marrëdhënien midis masës dhe numrit të atomeve në një mostër tipike të këtij elementi. Kjo është shumë e dobishme në laboratorët kimikë sepse është pothuajse e pamundur të numërosh me saktësi atomet, por masat përcaktohen lehtë. Për shembull, ju mund të peshoni një mostër argjendi dhe të dini se do të ketë një atom argjendi për çdo 107,8677 amu.
Shndërroni në masë molare. Njësia e masës atomike është shumë e vogël, kështu që kimistët shpesh përdorin njësinë gram për masë. Për fat të mirë ne kemi përkufizime të këtyre koncepteve, kështu që transformimi duhet të jetë i lehtë. Thjesht shumëzoni atomin mesatar të masës me 1 g / mol (konstanta e masës molare) për të marrë një rezultat në g / mol. Për shembull, 107.8677 gram argjend përmban një mol atome argjendi.
Gjeni masën mesatare molekulare. Meqenëse një molekulë është një koleksion i atomeve, ju mund të shtoni masën e të gjithë atomeve për të gjetur masën molekulare. Nëse do të përdornit një atom mesatar të masës (në vend të masës së një izotopi të veçantë), rezultati do të ishte masa molekulare mesatare e një mostre në natyrë. Këtu është një shembull:
- Një molekulë uji ka formulën kimike H2O përmban dy atome hidrogjeni (H) dhe një atom oksigjeni (O).
- Hidrogjeni ka një atom mesatar masiv prej 1,00794 amu. Oksigjeni ka një masë atomike mesatare prej 15,9994 amu.
- Pra, masa mesatare molekulare e H2O është e barabartë me (1,00794) (2) + 15,9994 = 18,01528 amu, që është ekuivalente me 18,01528 g / mol.
Këshilla
- Koncepti i masës atomike relative nganjëherë përdoret sinonim i një atomi me masë të mesme. Ekziston një ndryshim i vogël sepse masa atomike është relativisht unitet; është një matje e masës në raport me një atom karboni-12. Për sa kohë që përdorni njësinë e masës atomike në llogaritjen mesatare të atomit kub, këto dy vlera janë të njëjta.
- Numri në kllapa pas atomit kub na tregon gabimin. Për shembull, atomi i masës 1.0173 (4) do të thotë që atomi normal i elementit ka një diapazon masash rreth 1.0173 0.0004. Ju nuk keni nevojë ta merrni këtë numër nëse nuk kërkohet.
- Në tabelën periodike, atomi mesatar kub i elementit vijues është më i madh se ai para tij, me disa përjashtime. Këtu është një mënyrë e shpejtë për të kontrolluar rezultatet tuaja.
- 1 njësi e masës atomike është 1/12 e masës së një atomi karboni-12.
- Shkalla e mbijetesës së izotopit llogaritet sipas mostrave tipike që ndodhin natyrshëm në tokë. Substancat që nuk ndodhin natyrshëm si meteoritët ose ai i prodhuar në një laborator mund të kenë raporte të ndryshme izotopesh, kështu që atomi mesatar i masës është gjithashtu i ndryshëm.
Paralajmërim
- Atomet e masës shkruhen gjithmonë në njësi të masës atomike (amu ose u), ndonjëherë të quajtura daltone (Da). Asnjëherë mos shkruani një njësi tjetër të masës (siç është një kilogram) pas këtij numri pa e ndryshuar atë.
Çfarë ju duhet
- Laps
- Letër
- Laptop
- Të dhëna mbi nivelin e mbijetesës së izotopeve në natyrë.
- Të dhënat e njësisë atomike masive për izotopet.