Autor:
Lewis Jackson
Data E Krijimit:
8 Mund 2021
Datën E Azhurnimit:
25 Qershor 2024
Përmbajtje
Ekuacioni jonik neto është një pjesë e rëndësishme e kimisë sepse përfaqëson vetëm grimcat që ndryshojnë në një reaksion kimik. Ato përdoren më së shpeshti në reaksionet e zvogëlimit të oksidimit, reaksioneve metabolike dhe reaksioneve të neutralizimit të acideve - bazave. Ekzistojnë tre hapa themelorë për të shkruar një ekuacion jonik neto: ekuilibroni ekuacionin molekular, shndërroni atë në ekuacionin e plotë jonik (sipas mënyrës se si ekziston secila substancë në tretësirë) dhe në fund shkruani ekuacionin jonik neto.
Hapat
Pjesa 1 nga 2: Kuptimi i përbërësve të ekuacionit jonik
Di diferencën midis molekulave dhe përbërjet jonike. Hapi i parë për të shkruar një ekuacion jonik neto është përcaktimi i përbërjeve jonike në reaksion. Përbërjet jonike janë ato që ndajnë jonet në një tretësirë ujore dhe kanë një ngarkesë elektrike. Përbërjet molekulare janë përbërje që nuk kanë kurrë ngarkesë elektrike. Ato formohen midis dy jometaleve dhe nganjëherë referohen si përbërje kovalente.
- Komponimet jonike mund të formohen midis metaleve dhe jometaleve, metaleve dhe joneve poliatomike, ose joneve të shumëfishta polatomike.
- Nëse nuk jeni të sigurt se cili është përbërja, mund të kërkoni elementët në atë përbërje në sistemin periodik.

Të njohë tretshmërinë e një përbërësi. Jo të gjitha përbërjet jonike janë të tretshme në tretësirë ujore, dhe për këtë arsye nuk mund të ndahen në jone. Ju duhet të identifikoni tretshmërinë e secilës përbërje përpara se të vazhdoni me pjesën tjetër të ekuacionit. Më poshtë është një përmbledhje e rregullave për tretshmëri. Gjeni një tabelë të tretshmërisë për informacione më të hollësishme dhe përjashtime nga këto rregulla.- Ndiqni këto rregulla në rendin e përshkruar më poshtë:
- Të gjitha kripërat Na, K dhe NH4 të gjithë shpërndahen.
- Të gjitha JO kripëra3, C2H3O2, ClO3, dhe ClO4 të gjitha shkrihen.
- Të gjitha kripërat Ag, Pb dhe Hg2 të gjithë shpërndahen.
- Të gjitha kripërat Cl, Br dhe I janë të tretshme.
- Të gjitha kripërat e CO3, O, S, OH, PO4, CrO4, Cr2O7, dhe kështu3 të gjitha shpërbëhen (përveç në disa raste).
- Të gjitha kripërat SO4 janë tretur (përveç në disa raste).
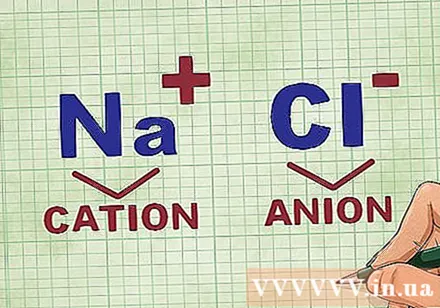
Përcaktimi i kationeve dhe anioneve në një përbërje. Kationet janë jone pozitive në një përbërje dhe zakonisht janë metali. Anioni është joni negativ në përbërje dhe është jometalik. Disa jometale mund të formojnë katione, por metalet gjithmonë formojnë katione.- Për shembull, në NaCl, Na është kation i ngarkuar pozitivisht sepse është një metal dhe Cl është anion i ngarkuar negativisht sepse është jometal.

Njohin jonet poliatomike në reaksion. Jonet poliatomike janë molekula të ngarkuara që janë të lidhura ngushtë së bashku dhe nuk ndahen gjatë reaksioneve kimike. Shtë e rëndësishme të njihen jonet poliatomike sepse ato kanë një ngarkesë specifike dhe nuk veçohen. Jonet poliatomike mund të kenë një ngarkesë pozitive ose negative.- Nëse jeni duke studiuar kimi të përgjithshme, shpesh kërkohet të mbani mend disa jone të zakonshme poliatomike.
- Disa jone të zakonshme poliatomike janë CO3, JO3, JO2, KËSHTU QË4, KËSHTU QË3, ClO4 dhe ClO3.
- Ju gjithashtu mund të gjeni shumë jone të tjera në librat e kimisë ose në internet.
Pjesa 2 nga 2: Shkrimi i një ekuacioni jonik neto
Bilanci i ekuacioneve molekulare. Para se të shkruani një ekuacion jonik neto, duhet të siguroheni që ekuacioni juaj molekular është i ekuilibruar. Për të ekuilibruar ekuacionin, shtoni koeficientë përpara përbërjes në mënyrë që numri atomik i secilit element të jetë i barabartë në të dy anët e ekuacionit.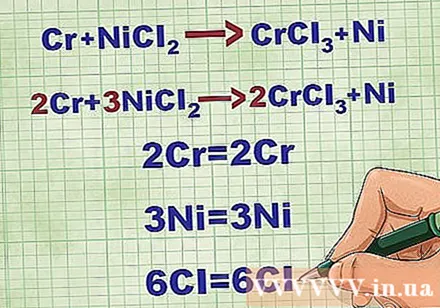
- Shkruani numrin e atomeve që përbëjnë secilën përbërje në të dy anët e ekuacionit.
- Shtoni një koeficient para elementeve të tjerë përveç oksigjenit dhe hidrogjenit për të ekuilibruar secilën anë.
- Bilanci i atomit të hidrogjenit.
- Bilanci atomik i oksigjenit.
- Tregoni numrin e atomeve në secilën anë të ekuacionit për t'u siguruar që ato janë të ekuilibruar.
- Për shembull, Cr + NiCl2 -> CrCl3 + Ni E balancuar në 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Identifikoni gjendjet e përbërjeve në ekuacion. Shumë herë në problem ka fjalë kyçe për t'ju njoftuar gjendjen e secilës përbërje. Ekzistojnë disa rregulla që ndihmojnë në përcaktimin e gjendjes së një elementi ose përbërësi.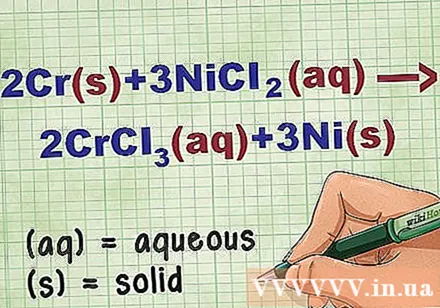
- Nëse nuk jepet asnjë gjendje për elementin, përdorni gjendjen që gjendet në sistemin periodik.
- Nëse përbërja quhet tretësirë, mund ta shkruani si ujore ose (dd).
- Nëse ka ujë në ekuacion, duhet të përcaktoni nëse përbërja jonike është e tretshme në ujë duke përdorur fletën e tretshme të tretshmërisë. Nëse tretshmëria është e lartë, përbërja do të jetë ujore (dd), nëse tretshmëria është e ulët, përbërja do të jetë e ngurtë (r).
- Pa ujë, përbërja jonike është e ngurtë (r).
- Nëse problemi është acid ose bazë, atëherë përbërja është ujore (dd).
- Për shembull, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Format elementare të Cr dhe Ni janë në gjendje të ngurtë. NiCl2 dhe CrCl3 përbërjet jonike janë të tretshme, kështu që ato janë ujore. Rishkruaj ekuacionin si: 2Cr(r) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(r).
Përcaktoni se cilat përbërës do të veçohen (shpërndahen në katione dhe anione) në tretësirë. Kur një substancë ose përbërje veçohet, ajo ndahet në një jon të ngarkuar pozitivisht (kation) dhe një jon të ngarkuar negativisht (anion). Këto janë përbërësit që do të ekuilibrohen në fund të ekuacionit jonik neto.
- Solidet, lëngjet, gazrat, përbërjet molekulare, përbërjet jonike të tretshmërisë së ulët, jonet poliatomike dhe acidet e dobëta nuk do të veçohen.
- Komponimet Jonike kanë një tretshmëri të lartë (përdorni tabelën e tretshmërisë) dhe acidet e forta do të jonizojnë 100% (HCl(dd), HBr(dd), HI(dd), H2KËSHTU QË4(dd), HClO4(dd), dhe HNO3(dd)).
- Vini re, megjithëse jonet poliatomike nuk ndahen më, nëse ato janë përbërëse të asaj përbërjeje, ato ndahen nga përbërja.
Llogaritni ngarkesën e secilit jon të shkëputur nga përbërja. Mos harroni se metalet do të formojnë jone pozitive dhe jometalet do të formojnë jone negative. Përdorni tabelën periodike për të përcaktuar ngarkesën e një elementi. Ju gjithashtu duhet të ekuilibroni ngarkesën e secilit jon në përbërje.
- Në këtë shembull, NiCl2 disociuar në Ni dhe Cl ndërsa CrCl3 u ndanë në Cr dhe Cl.
- Ni ka ngarkesë 2+ sepse Cl ka ngarkesë negative, por ka 2 atome. Prandaj, duhet të ekuilibrojmë 2 jonet Cl negative. Cr ka një ngarkesë 3+, kështu që duhet të ekuilibrojmë 3 jonet Cl negative.
- Mos harroni se jonet poliatomike kanë një ngarkesë specifike.
Shkruani ekuacionin e plotë jonik. Çdo gjë që veçon ose jonizon (acide të forta) ndahet në dy jone të ndara. Gjendja e substancës është akoma (dd), por sigurohuni që ekuacioni të mbetet i ekuilibruar.
- Solidet, lëngjet, gazrat, acidet e dobëta dhe përbërjet jonike të tretshmërisë së ulët nuk e ndryshojnë gjendjen ose nuk ndahen në jone. Ne i mbajmë ato të paprekura.
- Substancat molekulare do të shpërndahen në tretësirë në mënyrë që gjendja e tyre të ndryshojë në (dd) Tre përjashtime nuk jane bëhem (dd) është: CH4(k), C3H8(k), dhe C8H18(l).
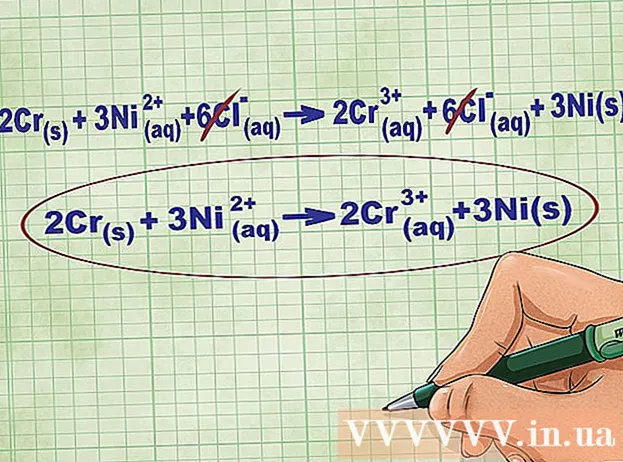
- Duke vazhduar me shembullin e mësipërm, ekuacioni i plotë jonik duket kështu: 2Cr(r) + 3Ni(dd) + 6Cl(dd) -> 2Kr(dd) + 6Cl(dd) + 3Ni(r). Kur Cl nuk është në një përbërje, nuk është bipolar, kështu që ne shumëzojmë faktorin me numrin e atomeve në përbërje për të marrë 6 jone Cl në të dy anët e ekuacionit.
Hiqni jonet e ekuilibrit duke anuluar të njëjtat jone në secilën anë të ekuacionit. Ju mund të anuloni vetëm nëse ato janë saktësisht të njëjta në të dy anët (ngarkesa, numri atomik, etj.). Rishkruaj ekuacionin pa substancat e shkatërrueshme.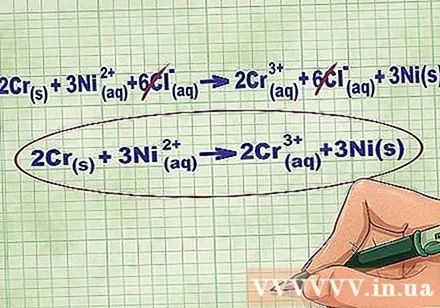
- Pas përfundimit të shembullit, kemi 6 jone të ekuilibrit Cl të anulueshme në secilën anë. Ekuacioni neto jonik është 2Cr(r) + 3Ni(dd) -> 2Kr(dd) + 3Ni(r).
- Nëse jeni i saktë, atëherë ngarkesa totale nga ana e reaguesit duhet të jetë e barabartë me ngarkesën totale në anën e produktit në ekuacionin jonik neto.
Këshilla
- Shkruani gjendjet e të gjitha substancave në ekuacion, nëse jo ju do të humb pikë.