Autor:
Florence Bailey
Data E Krijimit:
21 Marsh 2021
Datën E Azhurnimit:
1 Korrik 2024
Përmbajtje
- Hapa
- Metoda 1 nga 2: Shpërndarja e elektroneve duke përdorur sistemin periodik të D. I. Mendeleev
- Metoda 2 nga 2: Përdorimi i tabelës periodike të ADOMAH
- Këshilla
Konfigurimi elektronik një atom është një paraqitje numerike e orbitaleve të tij elektronike. Orbitalet elektronike janë rajone të formave të ndryshme të vendosura rreth një bërthame atomike në të cilën një elektron është matematikisht i mundshëm. Konfigurimi elektronik ndihmon për t'i treguar shpejt dhe lehtë lexuesit se sa orbitale elektronike ka një atom, si dhe përcakton numrin e elektroneve në secilën orbital. Pasi të keni lexuar këtë artikull, do të keni zotëruar metodën e krijimit të konfigurimeve elektronike.
Hapa
Metoda 1 nga 2: Shpërndarja e elektroneve duke përdorur sistemin periodik të D. I. Mendeleev
 1 Gjeni numrin atomik të atomit tuaj. Çdo atom ka një numër të caktuar elektronesh të lidhur me të. Gjeni simbolin për atomin tuaj në tabelën periodike. Një numër atomik është një numër i plotë pozitiv duke filluar nga 1 (për hidrogjen) dhe duke u rritur me një për secilin atom pasues. Një numër atomik është numri i protoneve në një atom, dhe për këtë arsye është edhe numri i elektroneve në një atom me ngarkesë zero.
1 Gjeni numrin atomik të atomit tuaj. Çdo atom ka një numër të caktuar elektronesh të lidhur me të. Gjeni simbolin për atomin tuaj në tabelën periodike. Një numër atomik është një numër i plotë pozitiv duke filluar nga 1 (për hidrogjen) dhe duke u rritur me një për secilin atom pasues. Një numër atomik është numri i protoneve në një atom, dhe për këtë arsye është edhe numri i elektroneve në një atom me ngarkesë zero. - 2 Përcaktoni ngarkesën e një atomi. Atomet neutrale do të kenë të njëjtin numër elektronesh siç tregohet në tabelën periodike. Sidoqoftë, atomet e ngarkuar do të kenë më shumë ose më pak elektrone, në varësi të sasisë së ngarkesës së tyre. Nëse jeni duke punuar me një atom të ngarkuar, shtoni ose hiqni elektronet si më poshtë: shtoni një elektron për çdo ngarkesë negative dhe zbritni një për çdo pozitiv.
- Për shembull, një atom natriumi me një ngarkesë -1 do të ketë një elektron shtesë përveç kësaj në numrin e tij atomik bazë 11. Me fjalë të tjera, atomi i përgjithshëm do të ketë 12 elektrone.
- Nëse po flasim për një atom natriumi me një ngarkesë +1, një elektron duhet të zbritet nga numri atomik bazë 11. Kështu, atomi do të ketë 10 elektrone.
- 3 Mos harroni listën bazë të orbitaleve. Ndërsa numri i elektroneve rritet, ato mbushin nën -nivelet e ndryshme të guaskës elektronike të atomit sipas një sekuence të caktuar. Çdo nën -nivel i guaskës elektronike, kur mbushet, përmban një numër çift elektronesh. Nën -nivelet e mëposhtme janë në dispozicion:
- s-nën-nivel (çdo numër në konfigurimin elektronik që vjen para shkronjës "s") përmban një orbital të vetëm, dhe, sipas Parimi i Paulit, një orbital mund të përmbajë një maksimum prej 2 elektrone, prandaj, mund të ketë 2 elektrone në secilën nën-nën-nivel të guaskës së elektroneve.
- p-nën-nivel përmban 3 orbitale, dhe për këtë arsye mund të përmbajë një maksimum prej 6 elektronesh.
- d-nën-nivel përmban 5 orbitale, kështu që mund të ketë deri në 10 elektrone.
- f-nën-nivel përmban 7 orbitale, kështu që mund të ketë deri në 14 elektrone.
- g-, h-, i- dhe k-nën-nivele janë teorike. Atomet që përmbajnë elektrone në këto orbitale janë të panjohura. Nën-niveli g përmban 9 orbitale, kështu që teorikisht mund të ketë 18 elektrone. Nën-niveli h mund të ketë 11 orbitale dhe një maksimum prej 22 elektronesh; në orbitalet e nën -nivelit -13 dhe një maksimum prej 26 elektronesh; në nën -nën -nivel - 15 orbitale dhe një maksimum prej 30 elektronesh.
- Mësoni përmendësh rendin e orbitaleve duke përdorur trukun mnemonik:
Sober Physikistët Dnuk është Find Girafe Hfshehje Unen Kitchens (fizikanët e matur nuk gjejnë gjirafa që fshihen në kuzhina).
- 4 Kuptoni regjistrimin elektronik të konfigurimit. Konfigurimet elektronike regjistrohen për të pasqyruar qartë numrin e elektroneve në çdo orbital. Orbitalet shkruhen në mënyrë të njëpasnjëshme, me numrin e atomeve në secilën orbital që mbivendoset në të djathtë të emrit të orbitës. Konfigurimi elektronik i përfunduar merr formën e një sekuence të përcaktimeve dhe nënshkrimeve të nën -nivelit.
- Për shembull, konfigurimi më i thjeshtë elektronik: 1s 2s 2p. Ky konfigurim tregon se ka dy elektrone në nën -nivelin 1s, dy elektrone në nën -nivelin 2s dhe gjashtë elektrone në nënplanin 2p. 2 + 2 + 6 = 10 elektrone në total. Ky është konfigurimi elektronik i një atomi neon neutral (numri atomik neoni është 10).
- 5 Mos harroni rendin e orbitaleve. Mbani në mend se orbitalet elektronike numërohen në rendin rritës të numrit të guaskës elektronike, por në rendin rritës të energjisë. Për shembull, një orbital i mbushur me 4s është më pak energjik (ose më pak i lëvizshëm) sesa një 3d i mbushur pjesërisht ose i mbushur, kështu që orbitalet 4s regjistrohen së pari. Pasi të dini rendin e orbitaleve, lehtë mund t'i plotësoni ato sipas numrit të elektroneve në atom. Rendi i mbushjes së orbitaleve është si më poshtë: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Konfigurimi elektronik i një atomi në të cilin mbushen të gjitha orbitalet do të ketë formën e mëposhtme: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Vini re se hyrja e mësipërme, kur mbushen të gjitha orbitalet, është konfigurimi elektronik i elementit Uuo (ununoctium) 118, atomi më i lartë i numëruar në tabelën periodike. Prandaj, ky konfigurim elektronik përmban të gjitha nën -nivelet elektronike të njohura aktualisht të një atomi të ngarkuar neutral.
- 6 Plotësoni orbitalet sipas numrit të elektroneve në atomin tuaj. Për shembull, nëse duam të shënojmë konfigurimin elektronik të një atomi neutral të kalciumit, duhet të fillojmë duke kërkuar numrin e tij atomik në tabelën periodike. Numri i tij atomik është 20, kështu që ne do të shkruajmë konfigurimin e një atomi me 20 elektrone sipas rendit të mësipërm.
- Plotësoni orbitalet sipas rendit të mësipërm derisa të arrini elektronin e njëzetë. Orbitalet e para 1s do të përmbajnë dy elektrone, orbitalet 2s gjithashtu do të kenë dy, 2p - gjashtë, 3s - dy, 3p - 6 dhe 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20.) Në me fjalë të tjera, konfigurimi elektronik i kalciumit është: 1s 2s 2p 3s 3p 4s.
- Vini re se orbitalet janë në rend ngjitje të energjisë. Për shembull, kur të jeni gati për të kaluar në nivelin e 4 -të të energjisë, atëherë së pari shkruani orbitën 4s, dhe atëherë 3d Pas nivelit të katërt të energjisë, shkoni në të pestin, ku përsëritet e njëjta rend. Kjo ndodh vetëm pas nivelit të tretë të energjisë.
- 7 Përdorni tabelën periodike si një çelës vizual. Ju ndoshta e keni vënë re tashmë se forma e tabelës periodike korrespondon me rendin e nën -niveleve elektronike në konfigurimet elektronike. Për shembull, atomet në kolonën e dytë nga e majta përfundojnë gjithmonë në "s", ndërsa atomet në skajin e djathtë të seksionit të hollë të mesëm përfundojnë gjithmonë në "d", dhe kështu me radhë. Përdorni tabelën periodike si një udhëzues vizual për të shkruar konfigurime - pasi rendi në të cilin shtoni orbitale korrespondon me pozicionin tuaj në tabelë. Shikoni më poshtë:
- Në veçanti, dy kolonat më të majta përmbajnë atome konfigurimet elektronike të të cilëve përfundojnë në s-orbitale, blloku i djathtë i tabelës përmban atome konfigurimet e të cilëve përfundojnë në p-orbitale, dhe në pjesën e poshtme, atomet përfundojnë në f-orbitale.
- Për shembull, kur shkruani konfigurimin elektronik të klorit, mendoni kështu: "Ky atom ndodhet në rreshtin e tretë (ose" periudha ") të tabelës periodike. Gjithashtu ndodhet në grupin e pestë të bllokut orbital p të sistemit periodik.Prandaj, konfigurimi i tij elektronik do të përfundojë në ..3p
- Ju lutemi vini re: elementët në rajonin e orbitaleve d dhe f të tabelës karakterizohen nga nivele energjie që nuk korrespondojnë me periudhën në të cilën ndodhen. Për shembull, rreshti i parë i bllokut të elementeve me d-orbitale korrespondon me orbitale 3d, megjithëse ndodhet në periudhën e 4-të, dhe rreshti i parë i elementeve me f-orbitale korrespondon me orbitën 4f, pavarësisht faktit se ajo është në periudhën e 6 -të.
- 8 Mësoni stenografinë për të shkruar konfigurime të gjata elektronike. Atomet në skajin e djathtë të tabelës periodike quhen gazra fisnike. Këta elementë janë kimikisht shumë të qëndrueshëm. Për të shkurtuar procesin e shkrimit të konfigurimeve të gjata elektronike, thjesht shkruani në kllapa katrore simbolin kimik të gazit fisnik më të afërt me më pak elektrone se atomi juaj, dhe pastaj vazhdoni të shkruani konfigurimin elektronik të niveleve të mëvonshme orbitale. Shikoni më poshtë:
- Për të kuptuar këtë koncept, është e dobishme të shkruani një shembull konfigurimi. Le të shkruajmë konfigurimin për zinkun (numri atomik 30) duke përdorur shkurtesën e gazit fisnik. Konfigurimi i plotë i zinkut duket kështu: 1s 2s 2p 3s 3p 4s 3d. Sidoqoftë, ne shohim se 1s 2s 2p 3s 3p është konfigurimi elektronik i argonit, një gaz fisnik. Thjesht zëvendësoni pjesën e konfigurimit elektronik të zinkut me simbolin kimik argon në kllapa katrore ([Ar].)
- Pra, konfigurimi elektronik i zinkut, i shkruar në një formë të shkurtuar, është: [Ar] 4s 3d.
- Vini re se nëse jeni duke shkruar konfigurimin elektronik të një gazi fisnik, të themi argon, nuk mund të shkruani [Ar]! Duhet përdorur reduktimi i gazit fisnik përballë këtij elementi; për argonin do të jetë neoni ([Ne]).
Metoda 2 nga 2: Përdorimi i tabelës periodike të ADOMAH
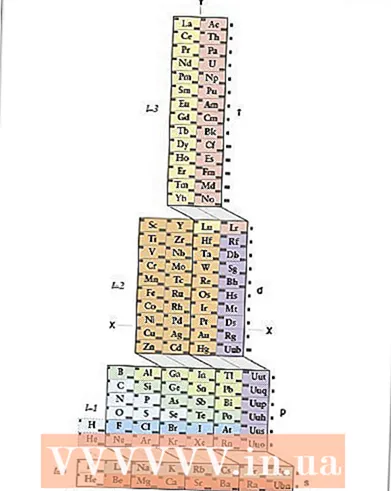
 1 Mësoni tabelën periodike ADOMAH. Kjo metodë e regjistrimit të konfigurimit elektronik nuk kërkon memorizim, megjithatë, kërkon një tabelë periodike të rishikuar, pasi në tabelën periodike tradicionale, duke filluar nga periudha e katërt, numri i periudhës nuk korrespondon me guaskën elektronike. Gjeni Tabelën Periodike të ADOMAH - një lloj i veçantë i tabelës periodike të zhvilluar nga shkencëtari Valery Zimmerman. Easyshtë e lehtë ta gjesh me një kërkim të shkurtër në internet.
1 Mësoni tabelën periodike ADOMAH. Kjo metodë e regjistrimit të konfigurimit elektronik nuk kërkon memorizim, megjithatë, kërkon një tabelë periodike të rishikuar, pasi në tabelën periodike tradicionale, duke filluar nga periudha e katërt, numri i periudhës nuk korrespondon me guaskën elektronike. Gjeni Tabelën Periodike të ADOMAH - një lloj i veçantë i tabelës periodike të zhvilluar nga shkencëtari Valery Zimmerman. Easyshtë e lehtë ta gjesh me një kërkim të shkurtër në internet. - Në tabelën periodike të ADOMAH, rreshtat horizontale përfaqësojnë grupe elementësh të tillë si halogjenë, gazra fisnikë, metale alkali, metale alkaline të tokës, etj. Kolonat vertikale korrespondojnë me nivelet elektronike, dhe të ashtuquajturat "kaskada" (linja diagonale që lidhin blloqet s, p, d dhe f) korrespondojnë me periodat.
- Heliumi zhvendoset në hidrogjen pasi të dy këta elementë kanë një orbital 1s. Blloqet e periudhës (s, p, d dhe f) janë treguar në anën e djathtë, dhe numrat e niveleve janë treguar në fund. Elementet tregohen në kutitë e numëruara nga 1 deri në 120. Këta numra janë numra atomikë të zakonshëm që përfaqësojnë numrin e përgjithshëm të elektroneve në një atom neutral.
- 2 Gjeni atomin tuaj në tabelën ADOMAH. Për të regjistruar konfigurimin elektronik të një elementi, gjeni simbolin e tij në tabelën periodike ADOMAH dhe kryqëzoni të gjithë elementët me një numër atomik më të lartë. Për shembull, nëse keni nevojë të shkruani konfigurimin elektronik të erbiumit (68), kryqëzoni të gjithë elementët nga 69 në 120.
- Vini re numrat 1 deri në 8 në fund të tabelës. Këta janë numrat e nivelit elektronik, ose numrat e kolonave. Injoroni kolonat që përmbajnë vetëm artikuj të kryqëzuar.Për erbiumin, kolonat e numëruara 1, 2, 3, 4, 5 dhe 6 mbeten.
- 3 Numëroni nën -nivelet orbitale në elementin tuaj. Duke parë simbolet e bllokut të treguar në të djathtë të tabelës (s, p, d dhe f) dhe numrat e kolonave të paraqitura në fund, injoroni linjat diagonale midis blloqeve dhe ndani kolonat në blloqe kolonash sipas rendit nga poshtë në krye. Përsëri, injoroni kutitë me të gjithë elementët e tejkaluar. Shkruani blloqet e kolonave, duke filluar me numrin e kolonës të ndjekur nga simboli i bllokut, kështu: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (për erbium).
- Shënim: Konfigurimi elektronik i mësipërm Er është shkruar në rendin rritës të numrit elektronik të nën -nivelit. Gjithashtu mund të shkruhet sipas radhës së mbushjes së orbitaleve. Për ta bërë këtë, ndiqni kaskadat nga poshtë lart, jo kolonat kur shkruani blloqet e kolonave: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Numëroni elektronet për secilën nën -nivel elektronik. Numëroni elementët në secilën bllok-kolonë që nuk u tejkaluan, duke bashkangjitur një elektron nga secili element dhe shkruani numrin e tyre pranë simbolit të bllokut për secilën bllok-kolonë si më poshtë: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s ... Në shembullin tonë, ky është konfigurimi elektronik i erbiumit.
- 5 Merrni parasysh konfigurimet e pasakta elektronike. Ekzistojnë tetëmbëdhjetë përjashtime tipike që lidhen me konfigurimin elektronik të atomeve në gjendjen më të ulët të energjisë, të quajtur edhe gjendja e energjisë tokësore. Ata nuk i binden rregullit të përgjithshëm vetëm në dy ose tre pozicionet e fundit të zëna nga elektronet. Në këtë rast, konfigurimi aktual elektronik supozon se elektronet janë në një gjendje me një energji më të ulët në krahasim me konfigurimin standard të atomit. Atomet e përjashtimit përfshijnë:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) dhe Cm (..., 5f7, 6d1, 7s2).
Këshilla
- Për të gjetur numrin atomik të një atomi kur shkruhet në konfigurim elektronik, thjesht shtoni të gjithë numrat që pasojnë shkronjat (s, p, d dhe f). Kjo funksionon vetëm për atomet neutrale, nëse keni të bëni me një jon, atëherë asgjë nuk do të funksionojë - ju duhet të shtoni ose zbritni numrin e elektroneve shtesë ose të humbur.
- Numri pas shkronjës është një mbishkrim, mos bëni gabim në kontroll.
- Nuk ka asnjë "stabilitet të një gjysmë të mbushur" nën-nivel. Ky është një thjeshtim. Çdo stabilitet që lidhet me nën -nivelet "gjysmë të mbushura" është për shkak të faktit se çdo orbital është i zënë nga një elektron, kështu që zmbrapsja midis elektroneve minimizohet.
- Çdo atom tenton në një gjendje të qëndrueshme, dhe konfigurimet më të qëndrueshme kanë mbushur nën -nivelet s dhe p (s2 dhe p6). Gazrat fisnikë kanë një konfigurim të tillë, prandaj ato rrallë hyjnë në reagime dhe ndodhen në të djathtë në tabelën periodike. Prandaj, nëse konfigurimi përfundon në 3p, atëherë i duhen dy elektrone për të arritur një gjendje të qëndrueshme (për të humbur gjashtë, përfshirë elektronet e nën-nivelit s, kërkohet më shumë energji, kështu që është më e lehtë të humbësh katër). Dhe nëse konfigurimi përfundon në 4d, atëherë duhet të humbasë tre elektrone për të arritur një gjendje të qëndrueshme. Përveç kësaj, nën-nivelet e nën-mbushura (s1, p3, d5 ..) janë më të qëndrueshme se, për shembull, p4 ose p2; megjithatë, s2 dhe p6 do të jenë edhe më të fuqishëm.
- Kur keni të bëni me një jon, kjo do të thotë se numri i protoneve nuk është i barabartë me numrin e elektroneve. Në këtë rast, ngarkesa e një atomi do të shfaqet në të djathtën e sipërme (si rregull) të simbolit kimik. Prandaj, një atom antimoni me një ngarkesë +2 ka konfigurimin elektronik 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Vini re se 5p ka ndryshuar në 5p. Kini kujdes kur konfigurimi i një atomi neutral përfundon në nën -nivele të ndryshme nga s dhe p. Kur i merrni elektronet, mund t'i merrni vetëm nga orbitalet e valencës (orbitale s dhe p).Prandaj, nëse konfigurimi përfundon në 4s 3d dhe atomi fiton një ngarkesë +2, atëherë konfigurimi do të përfundojë në 4s 3d. Ju lutemi vini re se 3d jo ndryshon, në vend që të humbasë elektronet s-orbitale.
- Ka kushte kur elektroni detyrohet të "shkojë në një nivel më të lartë energjie". Kur një nën-niveli i mungon një elektron në gjysmën ose mbushjen e plotë, merrni një elektron nga s ose p-nën-niveli më i afërt dhe lëvizeni atë në nën-nivelin që ka nevojë për një elektron.
- Ekzistojnë dy mundësi për regjistrimin e një konfigurimi elektronik. Ato mund të shkruhen sipas rendit rritës të numrave të nivelit të energjisë ose sipas rendit të mbushjes së orbitaleve të elektroneve, siç u tregua më lart për erbiumin.
- Ju gjithashtu mund të shkruani konfigurimin elektronik të një elementi duke shkruar vetëm konfigurimin e valencës, i cili është nën -nivelet e fundit s dhe p. Kështu, konfigurimi i valencës së antimonit do të ketë formën 5s 5p.
- Jona nuk është e njëjtë. It'sshtë shumë më e vështirë me ta. Kaloni dy nivele dhe ndiqni të njëjtin model në varësi të vendit ku keni filluar dhe sa i madh është numri i elektroneve.