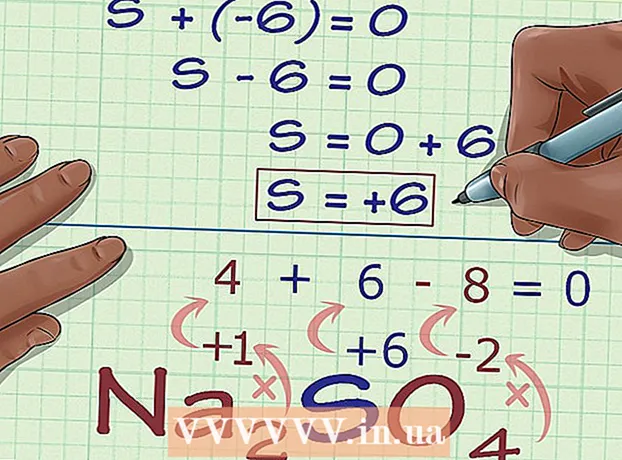
Përmbajtje
- Hapa
- Pjesa 1 nga 2: Përcaktimi i gjendjes së oksidimit sipas ligjeve të kimisë
- Pjesa 2 nga 2: Përcaktimi i gjendjes së oksidimit pa përdorur ligjet e kimisë
- Këshilla
- Cfare te nevojitet
Në kimi, termat "oksidim" dhe "reduktim" nënkuptojnë reagimet në të cilat një atom ose një grup atomesh humbin ose, përkatësisht, fitojnë elektrone. Gjendja e oksidimit është një vlerë numerike e caktuar për një ose më shumë atome që karakterizon numrin e elektroneve të rishpërndarë dhe tregon se si këto elektrone shpërndahen midis atomeve gjatë një reagimi. Përcaktimi i kësaj vlere mund të jetë një procedurë e thjeshtë dhe mjaft komplekse, në varësi të atomeve dhe molekulave që përbëhen prej tyre. Për më tepër, atomet e disa elementeve mund të kenë disa gjendje oksidimi. Për fat të mirë, ka rregulla të thjeshta të paqarta për përcaktimin e gjendjes së oksidimit, për përdorimin e sigurt të të cilave mjafton të njohësh bazat e kimisë dhe algjebrës.
Hapa
Pjesa 1 nga 2: Përcaktimi i gjendjes së oksidimit sipas ligjeve të kimisë
 1 Përcaktoni nëse substanca në fjalë është elementare. Gjendja e oksidimit të atomeve jashtë një përbërje kimike është zero. Ky rregull është i vërtetë si për substancat e formuara nga atome të veçantë të lirë, ashtu edhe për ato që përbëhen nga dy, ose molekula poliatomike të një elementi.
1 Përcaktoni nëse substanca në fjalë është elementare. Gjendja e oksidimit të atomeve jashtë një përbërje kimike është zero. Ky rregull është i vërtetë si për substancat e formuara nga atome të veçantë të lirë, ashtu edhe për ato që përbëhen nga dy, ose molekula poliatomike të një elementi. - Për shembull, Al(s) dhe Cl2 kanë një gjendje oksidimi 0, pasi të dyja janë në një gjendje elementare kimikisht të palidhur.
- Vini re se forma alotropike e squfurit S8, ose oktacera, pavarësisht strukturës së saj atipike, karakterizohet gjithashtu nga një gjendje oksidimi zero.
 2 Përcaktoni nëse substanca në fjalë përbëhet nga jone. Gjendja e oksidimit të joneve është e barabartë me ngarkesën e tyre. Kjo është e vërtetë si për jonet e lira ashtu edhe për ato që janë pjesë e përbërjeve kimike.
2 Përcaktoni nëse substanca në fjalë përbëhet nga jone. Gjendja e oksidimit të joneve është e barabartë me ngarkesën e tyre. Kjo është e vërtetë si për jonet e lira ashtu edhe për ato që janë pjesë e përbërjeve kimike. - Për shembull, gjendja e oksidimit të jonit Cl është -1.
- Gjendja e oksidimit të jonit Cl në përbërjen kimike NaCl është gjithashtu -1. Meqenëse joni Na, sipas përkufizimit, ka një ngarkesë +1, ne konkludojmë se ngarkesa e jonit Cl është -1, dhe kështu gjendja e tij e oksidimit është -1.
 3 Ju lutemi vini re se jonet metalike mund të kenë disa gjendje oksidimi. Atomet e shumë elementëve metalikë mund të jonizohen në sasi të ndryshme. Për shembull, ngarkesa jonike e një metali të tillë si hekuri (Fe) është +2 ose +3. Ngarkesa e joneve metalike (dhe gjendja e tyre e oksidimit) mund të përcaktohet nga ngarkesat e joneve të elementeve të tjerë me të cilët ky metal është pjesë e një përbërjeje kimike; në tekst, kjo ngarkesë shënohet me numra romakë: për shembull, hekuri (III) ka një gjendje oksidimi +3.
3 Ju lutemi vini re se jonet metalike mund të kenë disa gjendje oksidimi. Atomet e shumë elementëve metalikë mund të jonizohen në sasi të ndryshme. Për shembull, ngarkesa jonike e një metali të tillë si hekuri (Fe) është +2 ose +3. Ngarkesa e joneve metalike (dhe gjendja e tyre e oksidimit) mund të përcaktohet nga ngarkesat e joneve të elementeve të tjerë me të cilët ky metal është pjesë e një përbërjeje kimike; në tekst, kjo ngarkesë shënohet me numra romakë: për shembull, hekuri (III) ka një gjendje oksidimi +3. - Si shembull, merrni parasysh një përbërje që përmban një jon alumini. Ngarkesa totale e përbërjes AlCl3 është zero.Meqenëse ne e dimë se jonet Cl kanë një ngarkesë -1, dhe përbërja përmban 3 jone të tillë, për neutralitetin e përgjithshëm të substancës në fjalë, joni Al duhet të ketë një ngarkesë +3. Kështu, në këtë rast, gjendja e oksidimit të aluminit është +3.
 4 Gjendja e oksidimit të oksigjenit është -2 (me disa përjashtime). Pothuajse në të gjitha rastet, atomet e oksigjenit kanë një gjendje oksidimi -2. Ekzistojnë disa përjashtime nga ky rregull:
4 Gjendja e oksidimit të oksigjenit është -2 (me disa përjashtime). Pothuajse në të gjitha rastet, atomet e oksigjenit kanë një gjendje oksidimi -2. Ekzistojnë disa përjashtime nga ky rregull: - Nëse oksigjeni është në gjendje elementare (O2), gjendja e tij e oksidimit është 0, si në rastin e substancave të tjera elementare.
- Nëse oksigjeni është pjesë e peroksid, gjendja e tij e oksidimit është -1. Peroksidet janë një grup komponimesh që përmbajnë një lidhje të thjeshtë oksigjen-oksigjen (dmth. Anioni i peroksidit O)2) Për shembull, në përbërjen e H2O2 (peroksidi i hidrogjenit) oksigjeni ka një ngarkesë dhe gjendje oksidimi prej -1.
- Kur kombinohet me fluorin, oksigjeni ka një gjendje oksidimi +2, lexoni rregullin për fluorin më poshtë.
 5 Hidrogjeni ka një gjendje oksidimi +1, me disa përjashtime. Ashtu si me oksigjenin, ka edhe përjashtime. Si rregull, gjendja e oksidimit të hidrogjenit është +1 (nëse nuk është në gjendjen elementare H2) Sidoqoftë, në përbërjet e quajtura hidride, gjendja e oksidimit të hidrogjenit është -1.
5 Hidrogjeni ka një gjendje oksidimi +1, me disa përjashtime. Ashtu si me oksigjenin, ka edhe përjashtime. Si rregull, gjendja e oksidimit të hidrogjenit është +1 (nëse nuk është në gjendjen elementare H2) Sidoqoftë, në përbërjet e quajtura hidride, gjendja e oksidimit të hidrogjenit është -1. - Për shembull, në H2O Gjendja e oksidimit të hidrogjenit është +1 sepse atomi i oksigjenit ka një ngarkesë -2, dhe kërkohen dy ngarkesa +1 për neutralitetin e përgjithshëm. Sidoqoftë, në përbërjen e hidridit të natriumit, gjendja e oksidimit të hidrogjenit është tashmë -1, pasi joni Na mbart një ngarkesë prej +1, dhe për elektroneutralitetin e përgjithshëm, ngarkesa e atomit të hidrogjenit (dhe kështu gjendja e tij e oksidimit) duhet të jetë -1.
 6 Fluori gjithmone ka një gjendje oksidimi -1. Siç është vërejtur tashmë, gjendja e oksidimit të disa elementëve (jonet metalike, atomet e oksigjenit në peroksidet, dhe kështu me radhë) mund të ndryshojë në varësi të një numri faktorësh. Gjendja e oksidimit të fluorit, megjithatë, është pa ndryshim -1. Kjo është për shkak të faktit se ky element ka elektronegativitetin më të madh - me fjalë të tjera, atomet e fluorit janë më së paku të gatshëm të ndahen me elektronet e tyre dhe të tërheqin më aktivisht elektronet e huaja. Kështu, ngarkesa e tyre mbetet e pandryshuar.
6 Fluori gjithmone ka një gjendje oksidimi -1. Siç është vërejtur tashmë, gjendja e oksidimit të disa elementëve (jonet metalike, atomet e oksigjenit në peroksidet, dhe kështu me radhë) mund të ndryshojë në varësi të një numri faktorësh. Gjendja e oksidimit të fluorit, megjithatë, është pa ndryshim -1. Kjo është për shkak të faktit se ky element ka elektronegativitetin më të madh - me fjalë të tjera, atomet e fluorit janë më së paku të gatshëm të ndahen me elektronet e tyre dhe të tërheqin më aktivisht elektronet e huaja. Kështu, ngarkesa e tyre mbetet e pandryshuar.  7 Shuma e gjendjeve të oksidimit në një përbërje është e barabartë me ngarkesën e tij. Gjendjet e oksidimit të të gjithë atomeve që përbëjnë një përbërje kimike duhet të shtojnë ngarkesën e këtij përbërësi. Për shembull, nëse një përbërës është neutral, shuma e gjendjeve të oksidimit të të gjithë atomeve të tij duhet të jetë zero; nëse përbërja është një jon poliatomik me ngarkesë -1, shuma e gjendjeve të oksidimit është -1, e kështu me radhë.
7 Shuma e gjendjeve të oksidimit në një përbërje është e barabartë me ngarkesën e tij. Gjendjet e oksidimit të të gjithë atomeve që përbëjnë një përbërje kimike duhet të shtojnë ngarkesën e këtij përbërësi. Për shembull, nëse një përbërës është neutral, shuma e gjendjeve të oksidimit të të gjithë atomeve të tij duhet të jetë zero; nëse përbërja është një jon poliatomik me ngarkesë -1, shuma e gjendjeve të oksidimit është -1, e kështu me radhë. - Kjo është një metodë e mirë testimi - nëse shuma e gjendjeve të oksidimit nuk është e barabartë me ngarkesën totale të përbërjes, atëherë ju jeni gabim diku.
Pjesa 2 nga 2: Përcaktimi i gjendjes së oksidimit pa përdorur ligjet e kimisë
 1 Gjeni atome që nuk kanë rregulla strikte në lidhje me gjendjen e tyre të oksidimit. Për disa elementë, nuk ka rregulla të vendosura fort për gjetjen e gjendjes së oksidimit. Nëse një atom nuk i përshtatet asnjë prej rregullave të listuara më sipër, dhe ju nuk e njihni ngarkesën e tij (për shembull, atomi është pjesë e një kompleksi, dhe ngarkesa e tij nuk specifikohet), mund të përcaktoni gjendjen e oksidimit të një atomi të tillë me përjashtim. Së pari, përcaktoni ngarkesën e të gjithë atomeve të tjerë në përbërje, dhe më pas, nga ngarkesa totale e njohur e përbërjes, llogaritni gjendjen e oksidimit të këtij atomi.
1 Gjeni atome që nuk kanë rregulla strikte në lidhje me gjendjen e tyre të oksidimit. Për disa elementë, nuk ka rregulla të vendosura fort për gjetjen e gjendjes së oksidimit. Nëse një atom nuk i përshtatet asnjë prej rregullave të listuara më sipër, dhe ju nuk e njihni ngarkesën e tij (për shembull, atomi është pjesë e një kompleksi, dhe ngarkesa e tij nuk specifikohet), mund të përcaktoni gjendjen e oksidimit të një atomi të tillë me përjashtim. Së pari, përcaktoni ngarkesën e të gjithë atomeve të tjerë në përbërje, dhe më pas, nga ngarkesa totale e njohur e përbërjes, llogaritni gjendjen e oksidimit të këtij atomi. - Për shembull, në përbërjen Na2KËSHTU QË4 ngarkesa e atomit të squfurit (S) është e panjohur - ne e dimë vetëm se nuk është zero, pasi squfuri nuk është në një gjendje elementare. Ky komponim shërben si një shembull i mirë për të ilustruar metodën algjebrike për përcaktimin e gjendjes së oksidimit.
 2 Gjeni gjendjet e oksidimit të elementeve të mbetur në përbërje. Duke përdorur rregullat e përshkruara më lart, përcaktoni gjendjet e oksidimit të atomeve të mbetura të përbërjes. Mos harroni për përjashtimet nga rregulli për O, H, dhe kështu me radhë.
2 Gjeni gjendjet e oksidimit të elementeve të mbetur në përbërje. Duke përdorur rregullat e përshkruara më lart, përcaktoni gjendjet e oksidimit të atomeve të mbetura të përbërjes. Mos harroni për përjashtimet nga rregulli për O, H, dhe kështu me radhë. - Për Na2KËSHTU QË4, duke përdorur rregullat tona, ne gjejmë se ngarkesa (dhe kështu gjendja e oksidimit) e jonit Na është +1, dhe për secilin nga atomet e oksigjenit është -2.
 3 Shumëzoni numrin e atomeve me gjendjen e tyre të oksidimit. Tani që ne njohim gjendjet e oksidimit të të gjithë atomeve përveç një, është e nevojshme të merret parasysh se mund të ketë disa atome të disa elementeve. Shumëzoni numrin e atomeve të secilit element (tregohet në formulën kimike të përbërjes si nënshkrim pas simbolit të elementit) me gjendjen e tij të oksidimit.
3 Shumëzoni numrin e atomeve me gjendjen e tyre të oksidimit. Tani që ne njohim gjendjet e oksidimit të të gjithë atomeve përveç një, është e nevojshme të merret parasysh se mund të ketë disa atome të disa elementeve. Shumëzoni numrin e atomeve të secilit element (tregohet në formulën kimike të përbërjes si nënshkrim pas simbolit të elementit) me gjendjen e tij të oksidimit. - Në Na2KËSHTU QË4 kemi 2 atome Na dhe 4 atome O. Kështu, duke shumëzuar 2 × +1, marrim gjendjen e oksidimit të të gjithë atomeve të Na (2), dhe shumëzojmë 4 × -2 -gjendja e oksidimit të atomeve O (-8).
 4 Shtoni rezultatet e mëparshme. Duke përmbledhur rezultatet e shumëzimit, marrim gjendjen e oksidimit të përbërjes pa duke marrë parasysh kontributin e atomit të dëshiruar.
4 Shtoni rezultatet e mëparshme. Duke përmbledhur rezultatet e shumëzimit, marrim gjendjen e oksidimit të përbërjes pa duke marrë parasysh kontributin e atomit të dëshiruar. - Në shembullin tonë, për Na2KËSHTU QË4 shtojmë 2 dhe -8 dhe marrim -6.
 5 Gjeni gjendjen e panjohur të oksidimit nga ngarkesa e përbërjes. Tani i keni të gjitha të dhënat për të llogaritur me lehtësi gjendjen e dëshiruar të oksidimit. Shkruani një ekuacion, në anën e majtë të të cilit do të ketë shumën e numrit të marrë në hapin e mëparshëm të llogaritjes dhe gjendjen e panjohur të oksidimit, dhe në anën e djathtë të ngarkesës totale të përbërjes. Me fjale te tjera, (Shuma e gjendjeve të njohura të oksidimit) + (gjendja e dëshiruar e oksidimit) = (ngarkesa e një përbërjeje).
5 Gjeni gjendjen e panjohur të oksidimit nga ngarkesa e përbërjes. Tani i keni të gjitha të dhënat për të llogaritur me lehtësi gjendjen e dëshiruar të oksidimit. Shkruani një ekuacion, në anën e majtë të të cilit do të ketë shumën e numrit të marrë në hapin e mëparshëm të llogaritjes dhe gjendjen e panjohur të oksidimit, dhe në anën e djathtë të ngarkesës totale të përbërjes. Me fjale te tjera, (Shuma e gjendjeve të njohura të oksidimit) + (gjendja e dëshiruar e oksidimit) = (ngarkesa e një përbërjeje).- Në rastin tonë, Na2KËSHTU QË4 zgjidhja duket si kjo:
- (Shuma e gjendjeve të njohura të oksidimit) + (gjendja e dëshiruar e oksidimit) = (ngarkesa e përbërë)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2KËSHTU QË4 squfuri ka një gjendje oksidimi 6.
- Në rastin tonë, Na2KËSHTU QË4 zgjidhja duket si kjo:
Këshilla
- Në komponimet, shuma e të gjitha gjendjeve të oksidimit duhet të jetë e barabartë me ngarkesën. Për shembull, nëse përbërja është një jon diatomik, shuma e gjendjeve të oksidimit të atomeve duhet të jetë e barabartë me ngarkesën totale jonike.
- Veryshtë shumë e dobishme të jeni në gjendje të përdorni tabelën periodike dhe të dini se ku gjenden elementët metalikë dhe jo metalikë në të.
- Gjendja e oksidimit të atomeve në formë elementare është gjithmonë zero. Gjendja e oksidimit të një joni të vetëm është e barabartë me ngarkesën e tij. Elementet e grupit 1A të tabelës periodike, të tilla si hidrogjeni, litiumi, natriumi, në formë elementare kanë një gjendje oksidimi +1; Gjendja e oksidimit të metaleve të Grupit 2A, të tilla si magnezi dhe kalciumi, është +2 në formë elementare. Oksigjeni dhe hidrogjeni, në varësi të llojit të lidhjes kimike, mund të kenë 2 gjendje të ndryshme oksidimi.
Cfare te nevojitet
- Tabela periodike e elementeve
- Librat e referencës për qasjen në internet ose kiminë
- Një fletë letre, stilolaps ose laps
- Kalkulator