Autor:
Eric Farmer
Data E Krijimit:
10 Marsh 2021
Datën E Azhurnimit:
1 Korrik 2024
Përmbajtje
- Hapa
- Metoda 1 nga 2: Përcaktimi i numrit të neutroneve në atome (jo izotope)
- Metoda 2 nga 2: Përcaktimi i Numrit të Neutroneve në Izotope
- Këshilla
Në atomet e të njëjtit element, numri i protoneve është konstant, ndërsa numri i neutroneve mund të ndryshojë.Duke ditur se sa neutrone përmban një atom i veçantë, mund të përcaktoni nëse është një atom i rregullt apo një izotop që do të ketë më pak ose më shumë neutrone. Përcaktimi i numrit të neutroneve në një atom është mjaft i thjeshtë. E tëra çfarë ju duhet të bëni për të llogaritur numrin e neutroneve në një atom ose izotop është të ndiqni udhëzimet tona dhe ta mbani tabelën periodike në dispozicion.
Hapa
Metoda 1 nga 2: Përcaktimi i numrit të neutroneve në atome (jo izotope)
 1 Gjeni elementin në tabelën periodike. Si shembull, ne do të marrim parasysh osmiumin (Os), i cili është në periudhën e gjashtë (rreshti i gjashtë nga lart).
1 Gjeni elementin në tabelën periodike. Si shembull, ne do të marrim parasysh osmiumin (Os), i cili është në periudhën e gjashtë (rreshti i gjashtë nga lart).  2 Gjeni numrin atomik të elementit. Ky është, si rregull, numri më i dukshëm në qelizën e një elementi dhe zakonisht ndodhet mbi simbolin e tij (në versionin e tabelës periodike që ne përdorim në shembullin tonë, nuk ka numra të tjerë). Numri atomik është numri i protoneve në një atom të atij elementi. Për osmiumin, ky numër është 76, domethënë ka 76 protone në një atom osmiumi.
2 Gjeni numrin atomik të elementit. Ky është, si rregull, numri më i dukshëm në qelizën e një elementi dhe zakonisht ndodhet mbi simbolin e tij (në versionin e tabelës periodike që ne përdorim në shembullin tonë, nuk ka numra të tjerë). Numri atomik është numri i protoneve në një atom të atij elementi. Për osmiumin, ky numër është 76, domethënë ka 76 protone në një atom osmiumi. - Numri i protoneve është i pandryshuar, dhe kjo është ajo që e bën një element një element.
 3 Gjeni masën atomike të një elementi. Ky numër zakonisht gjendet nën simbolin e elementit. Ju lutemi vini re se në versionin e tabelës periodike në shembullin tonë, masa atomike nuk është dhënë (kjo nuk është gjithmonë rasti; në shumë versione të tabelës periodike, tregohet masa atomike). Masa atomike e osmiumit është 190.23.
3 Gjeni masën atomike të një elementi. Ky numër zakonisht gjendet nën simbolin e elementit. Ju lutemi vini re se në versionin e tabelës periodike në shembullin tonë, masa atomike nuk është dhënë (kjo nuk është gjithmonë rasti; në shumë versione të tabelës periodike, tregohet masa atomike). Masa atomike e osmiumit është 190.23.  4 Rrumbullakoni masën atomike në numrin e plotë më të afërt. Në shembullin tonë, 190.23 rrumbullakohet në 190.
4 Rrumbullakoni masën atomike në numrin e plotë më të afërt. Në shembullin tonë, 190.23 rrumbullakohet në 190. - Masa atomike është numri mesatar i izotopeve të një elementi të veçantë, zakonisht nuk shprehet si një numër i plotë.
 5 Zbritni numrin atomik nga masa atomike. Meqenëse protonet dhe neutronet përbëjnë pjesën absolute të masës atomike, duke zbritur numrin e protoneve (domethënë numrin atomik, i cili është i barabartë me numrin e protoneve) nga masa atomike jep numrin e neutroneve në atom. Numrat pas pikës dhjetore i referohen masës shumë të vogël të elektroneve në një atom. Në shembullin tonë: 190 (pesha atomike) - 76 (numri i protoneve) = 114 (numri i neutroneve).
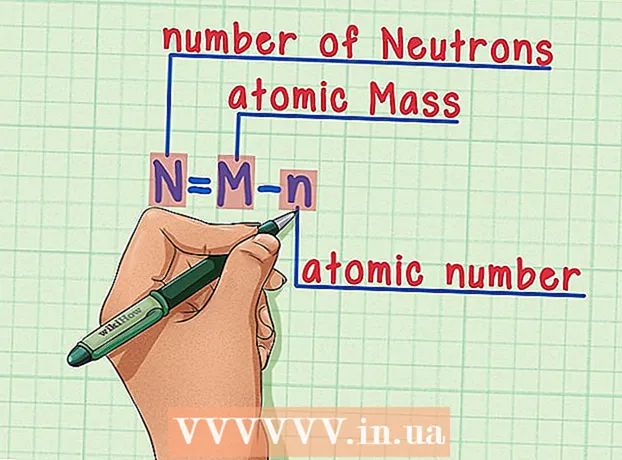
5 Zbritni numrin atomik nga masa atomike. Meqenëse protonet dhe neutronet përbëjnë pjesën absolute të masës atomike, duke zbritur numrin e protoneve (domethënë numrin atomik, i cili është i barabartë me numrin e protoneve) nga masa atomike jep numrin e neutroneve në atom. Numrat pas pikës dhjetore i referohen masës shumë të vogël të elektroneve në një atom. Në shembullin tonë: 190 (pesha atomike) - 76 (numri i protoneve) = 114 (numri i neutroneve).  6 Mos harroni formulën. Për të gjetur numrin e neutroneve në të ardhmen, thjesht përdorni këtë formulë:
6 Mos harroni formulën. Për të gjetur numrin e neutroneve në të ardhmen, thjesht përdorni këtë formulë: - N = M - n
- N = numri i neutroneve
- M = masë atomike
- n = numri atomik
- N = M - n
Metoda 2 nga 2: Përcaktimi i Numrit të Neutroneve në Izotope
 1 Gjeni elementin në tabelën periodike. Si shembull, ne do të marrim parasysh izotopin e karbonit 14C. Meqenëse karboni jo-izotopik 14C është vetëm karbon C, gjeni karbon në tabelën periodike (periudha e dytë ose rreshti i dytë nga lart).
1 Gjeni elementin në tabelën periodike. Si shembull, ne do të marrim parasysh izotopin e karbonit 14C. Meqenëse karboni jo-izotopik 14C është vetëm karbon C, gjeni karbon në tabelën periodike (periudha e dytë ose rreshti i dytë nga lart).  2 Gjeni numrin atomik të elementit. Ky është, si rregull, numri më i dukshëm në qelizën e një elementi dhe zakonisht ndodhet mbi simbolin e tij (në versionin e tabelës periodike që ne përdorim në shembullin tonë, nuk ka numra të tjerë). Numri atomik është numri i protoneve në një atom të atij elementi. Karboni është numri 6, që do të thotë se një karbon ka gjashtë protone.
2 Gjeni numrin atomik të elementit. Ky është, si rregull, numri më i dukshëm në qelizën e një elementi dhe zakonisht ndodhet mbi simbolin e tij (në versionin e tabelës periodike që ne përdorim në shembullin tonë, nuk ka numra të tjerë). Numri atomik është numri i protoneve në një atom të atij elementi. Karboni është numri 6, që do të thotë se një karbon ka gjashtë protone.  3 Gjeni masën atomike. Në rastin e izotopeve, kjo është shumë e lehtë për t'u bërë, pasi ato emërtohen sipas masës së tyre atomike. Në rastin tonë, karboni 14C ka një masë atomike prej 14. Tani ne e dimë masën atomike të izotopit; procesi i mëvonshëm i llogaritjes është i njëjtë me përcaktimin e numrit të neutroneve në atome (jo izotope).
3 Gjeni masën atomike. Në rastin e izotopeve, kjo është shumë e lehtë për t'u bërë, pasi ato emërtohen sipas masës së tyre atomike. Në rastin tonë, karboni 14C ka një masë atomike prej 14. Tani ne e dimë masën atomike të izotopit; procesi i mëvonshëm i llogaritjes është i njëjtë me përcaktimin e numrit të neutroneve në atome (jo izotope).  4 Zbritni numrin atomik nga masa atomike. Meqenëse protonet dhe neutronet përbëjnë pjesën absolute të masës atomike, duke zbritur numrin e protoneve (domethënë numrin atomik, i cili është i barabartë me numrin e protoneve) nga masa atomike jep numrin e neutroneve në atom. Në shembullin tonë: 14 (masa atomike) - 6 (numri i protoneve) = 8 (numri i neutroneve).
4 Zbritni numrin atomik nga masa atomike. Meqenëse protonet dhe neutronet përbëjnë pjesën absolute të masës atomike, duke zbritur numrin e protoneve (domethënë numrin atomik, i cili është i barabartë me numrin e protoneve) nga masa atomike jep numrin e neutroneve në atom. Në shembullin tonë: 14 (masa atomike) - 6 (numri i protoneve) = 8 (numri i neutroneve).  5 Mos harroni formulën. Për të gjetur numrin e neutroneve në të ardhmen, thjesht përdorni këtë formulë:
5 Mos harroni formulën. Për të gjetur numrin e neutroneve në të ardhmen, thjesht përdorni këtë formulë: - N = M - n
- N = numri i neutroneve
- M = masë atomike
- n = numri atomik
- N = M - n
Këshilla
- Protonet dhe neutronet përbëjnë pothuajse masën absolute të elementeve, ndërsa elektronet dhe grimcat e tjera përbëjnë një masë jashtëzakonisht të parëndësishme (kjo masë tenton në zero).Meqenëse një proton ka afërsisht të njëjtën masë si një neutron, dhe numri atomik është numri i protoneve, ju thjesht mund të zbritni numrin e protoneve nga masa e përgjithshme.
- Osmium - një metal në gjendje të ngurtë në temperaturën e dhomës, mori emrin nga fjala greke "osme" - erë.
- Nëse nuk jeni të sigurt se çfarë do të thotë një numër në tabelën periodike, mbani mend: tabela zakonisht ndërtohet rreth një numri atomik (domethënë, numrit të protoneve), i cili fillon me 1 (hidrogjen) dhe rritet një njësi nga e majta në të djathtë , duke përfunduar me 118 (Oganesson). Kjo ndodh sepse numri i protoneve në një atom përcakton vetë elementin, dhe një numër i tillë është mënyra më e lehtë për të organizuar elementet (për shembull, një atom me 2 protone është gjithmonë helium, ashtu si një atom me 79 protone është gjithmonë ari )



