Autor:
Janice Evans
Data E Krijimit:
25 Korrik 2021
Datën E Azhurnimit:
1 Korrik 2024
Përmbajtje
- Hapa
- Pjesa 1 nga 2: Përbërësit e Ekuacionit Jonik
- Pjesa 2 nga 2: Shkrimi i Ekuacioneve Jonike
- Këshilla
Ekuacionet jonike janë pjesë përbërëse e kimisë. Ato përmbajnë vetëm ato përbërës që ndryshojnë gjatë një reaksioni kimik. Më shpesh, ekuacionet jonike përdoren për të përshkruar reagimet redoks, reagimet e shkëmbimit dhe neutralizimit.Shkrimi i një ekuacioni jonik kërkon tre hapa themelorë: balancimin e ekuacionit molekular të një reaksioni kimik, përkthimin e tij në një ekuacion të plotë jonik (domethënë, shkrimin e përbërësve ashtu siç ekzistojnë në zgjidhje), dhe në fund shkrimin e një ekuacioni të shkurtër jonik.
Hapa
Pjesa 1 nga 2: Përbërësit e Ekuacionit Jonik
 1 Kuptoni ndryshimin midis molekulave dhe komponimet jonike. Për të shkruar ekuacionin jonik, hapi i parë është përcaktimi i përbërjeve jonike të përfshira në reaksion. Substancat jonike janë ato që shkëputen (zbërthehen) në jone të ngarkuar në tretësira ujore. Komponimet molekulare nuk zbërthehen në jone. Ato përbëhen nga dy elementë jo metalikë dhe nganjëherë quhen komponime kovalente.
1 Kuptoni ndryshimin midis molekulave dhe komponimet jonike. Për të shkruar ekuacionin jonik, hapi i parë është përcaktimi i përbërjeve jonike të përfshira në reaksion. Substancat jonike janë ato që shkëputen (zbërthehen) në jone të ngarkuar në tretësira ujore. Komponimet molekulare nuk zbërthehen në jone. Ato përbëhen nga dy elementë jo metalikë dhe nganjëherë quhen komponime kovalente. - Komponimet jonike mund të ndodhin midis një metali dhe një jometali, një metali dhe jonesh poliatomike, ose midis disa joneve poliatomikë.
- Nëse jeni në dyshim se cilit grup i përket një përbërje e veçantë, shikoni vetitë e elementeve përbërës të tij në tabelën periodike.
 2 Përcaktoni tretshmërinë e përbërjes. Jo të gjitha komponimet jonike treten në tretësira ujore, domethënë jo të gjitha shkëputen në jone të veçanta. Para se të filloni të shkruani ekuacionin, duhet të gjeni tretshmërinë e secilit përbërës. Më poshtë janë rregullat e shkurtra për tretshmërinë. Më shumë detaje dhe përjashtime nga rregulli mund të gjenden në tabelën e shpërbërjes.
2 Përcaktoni tretshmërinë e përbërjes. Jo të gjitha komponimet jonike treten në tretësira ujore, domethënë jo të gjitha shkëputen në jone të veçanta. Para se të filloni të shkruani ekuacionin, duhet të gjeni tretshmërinë e secilit përbërës. Më poshtë janë rregullat e shkurtra për tretshmërinë. Më shumë detaje dhe përjashtime nga rregulli mund të gjenden në tabelën e shpërbërjes. - Ndiqni rregullat sipas radhës në të cilat janë dhënë më poshtë:
- të gjitha kripërat Na, K dhe NH4 tretem;
- të gjitha kripërat JO3, C2H3O2, ClO3 dhe ClO4 i tretshëm;
- të gjitha kripërat Ag, Pb dhe Hg2 i pazgjidhshëm;
- të gjitha kripërat Cl, Br dhe I treten;
- kripërat CO3, O, S, OH, PO4, CrO4, Cr2O7 dhe kështu3 i pazgjidhshëm (me disa përjashtime);
- SO kripëra4 i tretshëm (me disa përjashtime).
 3 Përcaktoni kationin dhe anionin e përbërjes. Jonet e ngarkuar pozitivisht (zakonisht metalet) quhen katione. Anionet kanë një ngarkesë negative, zakonisht jonet jo metalike. Disa jo-metale mund të formojnë jo vetëm anione, por edhe katione, ndërsa atomet e metaleve veprojnë gjithmonë si katione.
3 Përcaktoni kationin dhe anionin e përbërjes. Jonet e ngarkuar pozitivisht (zakonisht metalet) quhen katione. Anionet kanë një ngarkesë negative, zakonisht jonet jo metalike. Disa jo-metale mund të formojnë jo vetëm anione, por edhe katione, ndërsa atomet e metaleve veprojnë gjithmonë si katione. - Për shembull, në përbërjen NaCl (kripë tryeze), Na është një kation i ngarkuar pozitivisht pasi është një metal dhe Cl është një anion i ngarkuar negativisht pasi nuk është një metal.
 4 Përcaktoni jonet poliatomike (komplekse) të përfshira në reaksion. Jonet e tilla janë molekula të ngarkuara, midis atomeve të të cilëve ekziston një lidhje aq e fortë saqë nuk shkëputen në reaksionet kimike. Isshtë e nevojshme të identifikohen jonet poliatomike, pasi ato kanë ngarkesën e tyre dhe nuk kalbet në atome individuale. Jonet poliatomike mund të kenë ngarkesa pozitive dhe negative.
4 Përcaktoni jonet poliatomike (komplekse) të përfshira në reaksion. Jonet e tilla janë molekula të ngarkuara, midis atomeve të të cilëve ekziston një lidhje aq e fortë saqë nuk shkëputen në reaksionet kimike. Isshtë e nevojshme të identifikohen jonet poliatomike, pasi ato kanë ngarkesën e tyre dhe nuk kalbet në atome individuale. Jonet poliatomike mund të kenë ngarkesa pozitive dhe negative. - Në kursin tuaj të përgjithshëm të kimisë, ka të ngjarë të keni nevojë të mësoni përmendësh disa nga jonet poliatomikë më të zakonshëm.
- Jonet poliatomike më të zakonshme janë CO3, JO3, JO2, KËSHTU QË4, KËSHTU QË3, ClO4 dhe ClO3.
- Ka shumë jone të tjera poliatomike që mund të gjenden në një libër shkollor të kimisë ose në internet.
Pjesa 2 nga 2: Shkrimi i Ekuacioneve Jonike
 1 Balanconi ekuacionin e plotë molekular. Para se të filloni të shkruani ekuacionin jonik, duhet të balanconi ekuacionin molekular origjinal. Për ta bërë këtë, është e nevojshme të vendosni koeficientët përkatës para komponimeve, në mënyrë që numri i atomeve të secilit element në anën e majtë të jetë i barabartë me numrin e tyre në anën e djathtë të ekuacionit.
1 Balanconi ekuacionin e plotë molekular. Para se të filloni të shkruani ekuacionin jonik, duhet të balanconi ekuacionin molekular origjinal. Për ta bërë këtë, është e nevojshme të vendosni koeficientët përkatës para komponimeve, në mënyrë që numri i atomeve të secilit element në anën e majtë të jetë i barabartë me numrin e tyre në anën e djathtë të ekuacionit. - Shkruani numrin e atomeve për secilin element në secilën anë të ekuacionit.
- Shtoni koeficientë para elementeve (përveç oksigjenit dhe hidrogjenit) në mënyrë që numri i atomeve të secilit element në anën e majtë dhe të djathtë të ekuacionit të jetë i njëjtë.
- Balanconi atomet e hidrogjenit.
- Balanconi atomet e oksigjenit.
- Numëroni numrin e atomeve për secilin element në secilën anë të ekuacionit dhe sigurohuni që të jetë i njëjtë.
- Për shembull, pas balancimit të ekuacionit Cr + NiCl2 -> CrCl3 + Ni marrim 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
 2 Përcaktoni gjendjen e secilës substancë që merr pjesë në reaksion. Kjo shpesh mund të gjykohet nga gjendja e problemit. Ekzistojnë disa rregulla që ndihmojnë në përcaktimin se në çfarë gjendje është një element ose një lidhje.
2 Përcaktoni gjendjen e secilës substancë që merr pjesë në reaksion. Kjo shpesh mund të gjykohet nga gjendja e problemit. Ekzistojnë disa rregulla që ndihmojnë në përcaktimin se në çfarë gjendje është një element ose një lidhje. - Nëse gjendja e një elementi të veçantë nuk tregohet në gjendjen e problemit, përdorni tabelën periodike për ta përcaktuar atë.
- Nëse gjendja thotë se përbërësi është në tretësirë, shënojeni atë (rr).
- Nëse uji përfshihet në ekuacion, përdorni tabelën e tretshmërisë për të përcaktuar nëse përbërja jonike do të shkëputet. Në rastin e tretshmërisë së lartë, përbërja shkëputet në ujë (rr) Nëse përbërësi ka tretshmëri të ulët, ai do të mbetet i ngurtë (tv).
- Nëse uji nuk merr pjesë në reaksion, përbërja jonike do të mbetet në formë të ngurtë (tv).
- Nëse në problem shfaqet një acid ose një bazë, ato do të treten në ujë (rr).
- Si shembull, merrni parasysh reagimin 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Në formë të pastër, elementët Cr dhe Ni janë në fazën e ngurtë. NiCl2 dhe CrCl3 janë komponime jonike të tretshme, domethënë ato janë në tretësirë. Kështu, ky ekuacion mund të rishkruhet si më poshtë: 2Cr(tv) + 3NiCl2(rr) -> 2CrCl3(rr) + 3Ni(tv).
 3 Përcaktoni cilat komponime shpërndahen (ndahen në katione dhe anione) në tretësirë. Pas ndarjes, përbërja zbërthehet në përbërës pozitiv (kation) dhe negativ (anion). Këta përbërës më pas do të hyjnë në ekuacionin jonik të reaksionit kimik.
3 Përcaktoni cilat komponime shpërndahen (ndahen në katione dhe anione) në tretësirë. Pas ndarjes, përbërja zbërthehet në përbërës pozitiv (kation) dhe negativ (anion). Këta përbërës më pas do të hyjnë në ekuacionin jonik të reaksionit kimik. - Materialet e ngurta, lëngjet, gazrat, përbërjet molekulare, përbërjet jonike me tretshmëri të ulët, jonet poliatomike dhe acidet e dobëta nuk shkëputen.
- Shkëput plotësisht komponimet jonike shumë të tretshme (përdorni tabelën e tretshmërisë) dhe acidet e forta (HCl(rr), HBr(rr), HI(rr), H2KËSHTU QË4(rr), HClO4(rr) dhe HNO3(rr)).
- Vini re se edhe pse jonet poliatomike nuk shkëputen, ato mund të përfshihen në përbërjen jonike dhe të ndahen prej tij në tretësirë.
 4 Llogaritni ngarkesën e secilit jon të shkëputur. Duke vepruar kështu, mbani mend se metalet formojnë katione me ngarkesë pozitive dhe atomet jo metalikë kthehen në anione negative. Përcaktoni ngarkesat e elementeve sipas tabelës periodike. Alsoshtë gjithashtu e nevojshme për të balancuar të gjitha ngarkesat në komponimet neutrale.
4 Llogaritni ngarkesën e secilit jon të shkëputur. Duke vepruar kështu, mbani mend se metalet formojnë katione me ngarkesë pozitive dhe atomet jo metalikë kthehen në anione negative. Përcaktoni ngarkesat e elementeve sipas tabelës periodike. Alsoshtë gjithashtu e nevojshme për të balancuar të gjitha ngarkesat në komponimet neutrale. - Në shembullin e mësipërm, NiCl2 shkëputet në Ni dhe Cl, dhe CrCl3 zbërthehet në Cr dhe Cl.
- Joni i nikelit ka një ngarkesë 2+ sepse është i lidhur me dy jone klor, secili me një ngarkesë të vetme negative. Në këtë rast, një jon Ni duhet të balancojë dy jone Cl të ngarkuar negativisht. Joni Cr ka një ngarkesë 3+, pasi duhet të neutralizojë tre jone Cl të ngarkuar negativisht.
- Mos harroni se jonet poliatomike kanë ngarkesat e tyre.
 5 Rishkruani ekuacionin në mënyrë që të gjitha komponimet e tretshme të ndahen në jone individuale. Çdo gjë që shkëputet ose jonizohet (si acidet e forta) zbërthehet në dy jone të veçantë. Në këtë rast, substanca do të mbetet në një gjendje të tretur (rr) Kontrolloni që ekuacioni të jetë i balancuar.
5 Rishkruani ekuacionin në mënyrë që të gjitha komponimet e tretshme të ndahen në jone individuale. Çdo gjë që shkëputet ose jonizohet (si acidet e forta) zbërthehet në dy jone të veçantë. Në këtë rast, substanca do të mbetet në një gjendje të tretur (rr) Kontrolloni që ekuacioni të jetë i balancuar. - Ngurtat, lëngjet, gazrat, acidet e dobëta dhe përbërjet jonike me tretshmëri të ulët nuk do të ndryshojnë gjendjen e tyre dhe nuk do të ndahen në jone. Lërini ato siç ishin.
- Komponimet molekulare thjesht do të shpërndahen në tretësirë dhe gjendja e tyre do të ndryshojë në tretur (rr) Ekzistojnë tre komponime molekulare që jo do të shkojë në shtet (rr), kjo është CH4(G), C3H8(G) dhe C8H18(f).
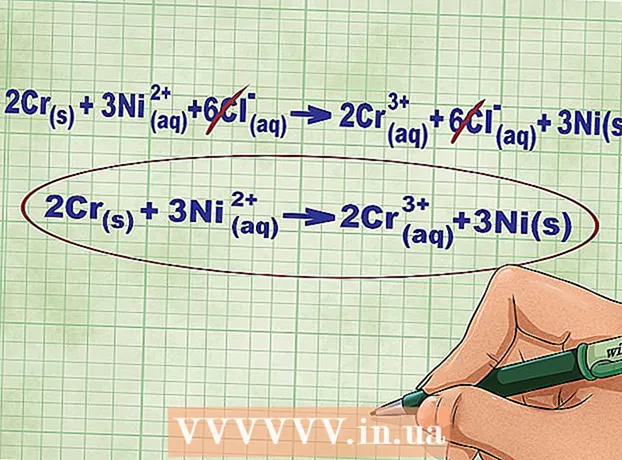
- Për reagimin në shqyrtim, ekuacioni i plotë jonik mund të shkruhet në formën e mëposhtme: 2Cr(tv) + 3Ni(rr) + 6Cl(rr) -> 2Cr(rr) + 6Cl(rr) + 3Ni(tv)... Nëse klori nuk është pjesë e përbërjes, ai zbërthehet në atome individuale, kështu që ne shumëzuam numrin e joneve Cl me 6 në të dy anët e ekuacionit.
 6 Anuloni jonet e barabarta në anën e majtë dhe të djathtë të ekuacionit. Ju mund të anashkaloni vetëm ato jone që janë plotësisht identikë në të dy anët e ekuacionit (kanë të njëjtat ngarkesa, nënshkrime etj.). Rishkruani ekuacionin pa këto jone.
6 Anuloni jonet e barabarta në anën e majtë dhe të djathtë të ekuacionit. Ju mund të anashkaloni vetëm ato jone që janë plotësisht identikë në të dy anët e ekuacionit (kanë të njëjtat ngarkesa, nënshkrime etj.). Rishkruani ekuacionin pa këto jone. - Në shembullin tonë, të dy anët e ekuacionit përmbajnë 6 jone Cl që mund të tejkalohen. Kështu, marrim një ekuacion të shkurtër jonik: 2Cr(tv) + 3Ni(rr) -> 2Cr(rr) + 3Ni(tv).
- Kontrolloni rezultatin. Ngarkesat totale të anës së majtë dhe të djathtë të ekuacionit jonik duhet të jenë të barabarta.
Këshilla
- Trajnoni veten gjithmone shkruani gjendjen e grumbullimit të të gjithë përbërësve në të gjitha ekuacionet e reaksioneve kimike.