Autor:
Frank Hunt
Data E Krijimit:
13 Marsh 2021
Datën E Azhurnimit:
1 Korrik 2024
Përmbajtje
- Të shkelësh
- Metoda 1 nga 3: Përdorimi i njehsorit pH
- Metoda 2 e 3: Me letër lakmusi
- Metoda 3 nga 3: Kuptimi i pH
Shtë e rëndësishme të matni pH - shkallën e aciditetit ose alkalitetit - të ujit. Uji përdoret nga bimët dhe kafshët nga të cilat varemi dhe e pimë çdo ditë. Vlera e pH e ujit mund të jetë një tregues i ndotjes së mundshme, kështu që matja e pH të ujit mund të jetë një masë paraprake e rëndësishme e shëndetit publik.
Të shkelësh
Metoda 1 nga 3: Përdorimi i njehsorit pH
 Kalibroni sondën dhe njehsorin sipas udhëzimeve të fabrikës. Ju mund të duhet të kalibroni njehsorin duke përdorur një substancë me një vlerë të njohur të pH. Matësi mund të rregullohet në përputhje me atë substancë. Nëse do të provoni ujë jashtë një laboratori, rekomandohet që ta kryeni këtë kalibrim disa orë para testimit në terren.
Kalibroni sondën dhe njehsorin sipas udhëzimeve të fabrikës. Ju mund të duhet të kalibroni njehsorin duke përdorur një substancë me një vlerë të njohur të pH. Matësi mund të rregullohet në përputhje me atë substancë. Nëse do të provoni ujë jashtë një laboratori, rekomandohet që ta kryeni këtë kalibrim disa orë para testimit në terren. - Shpëlajeni sondën me ujë të pastër para përdorimit. Thani me një leckë të pastër.
 Merrni një mostër uji dhe hidheni në një enë të pastër.
Merrni një mostër uji dhe hidheni në një enë të pastër.- Uji duhet të jetë mjaft i thellë për të zhytur majën e elektrodës.
- Lëreni kampionin për një kohë për të lejuar që temperatura të stabilizohet.
- Matni temperaturën e mostrës me një termometër.
 Rregulloni njehsorin me temperaturën e kampionit. Ndjeshmëria e sondës ndikohet nga temperatura e ujit, kështu që matja mund të jetë e saktë vetëm nëse futni të dhënat e temperaturës.
Rregulloni njehsorin me temperaturën e kampionit. Ndjeshmëria e sondës ndikohet nga temperatura e ujit, kështu që matja mund të jetë e saktë vetëm nëse futni të dhënat e temperaturës.  Vendosni sondën në mostër. Prisni që matësi të arrijë ekuilibrin. Matësi është në gjendje të qëndrueshme kur leximi është i qëndrueshëm.
Vendosni sondën në mostër. Prisni që matësi të arrijë ekuilibrin. Matësi është në gjendje të qëndrueshme kur leximi është i qëndrueshëm.  Lexoni matjen e pH të mostrës. Matësi i pH jep rezultatin në një shkallë prej 0-14. Nëse uji është i pastër, vlera është rreth 7. Shkruani gjetjet tuaja.
Lexoni matjen e pH të mostrës. Matësi i pH jep rezultatin në një shkallë prej 0-14. Nëse uji është i pastër, vlera është rreth 7. Shkruani gjetjet tuaja.
Metoda 2 e 3: Me letër lakmusi
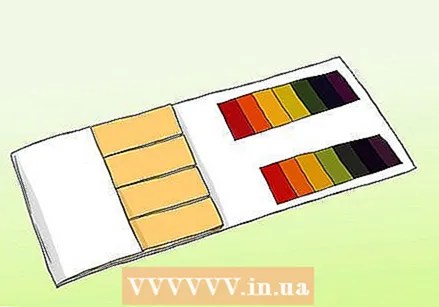 Mësoni ndryshimin midis letrës pH dhe letrës lakmus. Ju mund të përdorni letër pH për të marrë një lexim të saktë të një mostre. Sidoqoftë, letra me pH nuk duhet të ngatërrohet me letrën e rregullt të lakmusit. Të dyja mund të përdoren për të provuar për acide dhe baza, por ato ndryshojnë në aspekte të rëndësishme.
Mësoni ndryshimin midis letrës pH dhe letrës lakmus. Ju mund të përdorni letër pH për të marrë një lexim të saktë të një mostre. Sidoqoftë, letra me pH nuk duhet të ngatërrohet me letrën e rregullt të lakmusit. Të dyja mund të përdoren për të provuar për acide dhe baza, por ato ndryshojnë në aspekte të rëndësishme. - Shiritat e pH përmbajnë një seri shiritash tregues që ndryshojnë ngjyrën kur ekspozohen ndaj një tretësire. Forca e acideve dhe bazave në secilën shirit ndryshon. Pas ndryshimit, modeli i ngjyrës mund të krahasohet me mostrat e furnizuar me çantën.
- Letra e lakmusit është një shirit letre që përmban një acid ose bazë (alkaline). Vijat më të zakonshme janë të kuqe (me një acid që reagon me baza) dhe blu (me një bazë që reagon me acide). Vija e kuqe bëhet blu nëse substanca është alkaline, dhe vija blu kthehet e kuqe nëse substanca është acid. Gazetat e lakmusit mund të përdoren si një provë e shpejtë dhe e lehtë, por varietetet më të lira jo gjithmonë japin një masë të saktë të forcës së tretësirës.
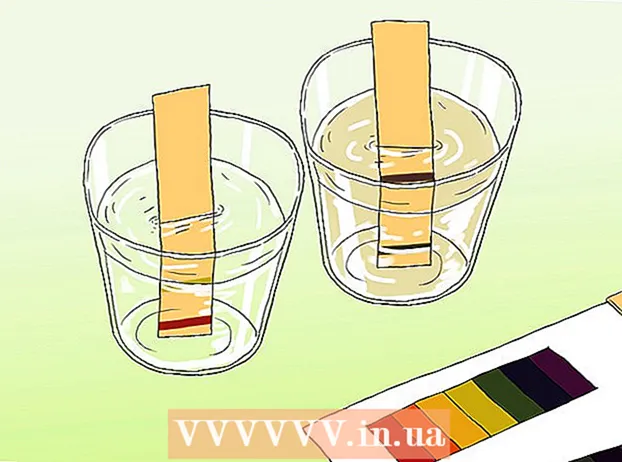
 Merrni një mostër të ujit dhe hidheni në një enë të pastër. Uji duhet të jetë mjaft i thellë për të zhytur shiritin.
Merrni një mostër të ujit dhe hidheni në një enë të pastër. Uji duhet të jetë mjaft i thellë për të zhytur shiritin.  Zhyt një shirit provë në mostër. Ekspozimi i disa sekondave është i mjaftueshëm. Shiritat tregues në letër do të ndryshojnë ngjyrën pas disa çastesh.
Zhyt një shirit provë në mostër. Ekspozimi i disa sekondave është i mjaftueshëm. Shiritat tregues në letër do të ndryshojnë ngjyrën pas disa çastesh.  Krahasoni fundin e shiritit të provës me tabelën e ngjyrave që erdhi me letrën. Ngjyra ose ngjyrat në kartelë duhet të përputhen me ngjyrën ose ngjyrat në shiritin e provës. Harta e ngjyrave pastaj lidh modelet e ngjyrave me nivelet e pH.
Krahasoni fundin e shiritit të provës me tabelën e ngjyrave që erdhi me letrën. Ngjyra ose ngjyrat në kartelë duhet të përputhen me ngjyrën ose ngjyrat në shiritin e provës. Harta e ngjyrave pastaj lidh modelet e ngjyrave me nivelet e pH.
Metoda 3 nga 3: Kuptimi i pH
 Mësoni se si përcaktohen acidet dhe bazat. Aciditeti dhe alkaliniteti (termi i përdorur për të përshkruar bazat) përcaktohen të dy nga jonet e hidrogjenit që dhurojnë ose marrin. Një acid është një substancë që dhuron (ose "dhuron") jone hidrogjeni, dhe një bazë është një substancë që thith jone shtesë të hidrogjenit.
Mësoni se si përcaktohen acidet dhe bazat. Aciditeti dhe alkaliniteti (termi i përdorur për të përshkruar bazat) përcaktohen të dy nga jonet e hidrogjenit që dhurojnë ose marrin. Një acid është një substancë që dhuron (ose "dhuron") jone hidrogjeni, dhe një bazë është një substancë që thith jone shtesë të hidrogjenit.  Kuptoni shkallën e pH. Numri i pH përdoret për të matur shkallën e aciditetit ose alkalinitetit të substancave të tretshme në ujë. Uji normalisht ka të njëjtën sasi të joneve hidroksid (OH−) dhe joneve hidronium (H3O +). Raporti i joneve të hidroksidit dhe hidronit ndryshon kur një ujë acid ose alkaline shtohet në ujë.
Kuptoni shkallën e pH. Numri i pH përdoret për të matur shkallën e aciditetit ose alkalinitetit të substancave të tretshme në ujë. Uji normalisht ka të njëjtën sasi të joneve hidroksid (OH−) dhe joneve hidronium (H3O +). Raporti i joneve të hidroksidit dhe hidronit ndryshon kur një ujë acid ose alkaline shtohet në ujë. - Zakonisht konsiderohet një shkallë që shkon nga 0 në 14 (megjithëse substancat mund të bien jashtë këtij kufiri). Substancat neutrale shënojnë rreth 7, substancat acide janë nën 7 dhe substancat alkaline mbi 7.
- Shkalla e pH është logaritmike, që do të thotë se ndryshimet e plota paraqesin një ndryshim dhjetëfish në aciditet ose alkalitet. Për shembull, një substancë me pH 2 është dhjetë herë më acid se një substancë me pH 3 dhe 100 herë më acid se një substancë me pH 4. Shkalla funksionon në të njëjtën mënyrë me substancat alkaline, me çdo qenia e plotë paraqet një ndryshim dhjetëfish.
 Mësoni pse provojmë pH e ujit. Uji i pastër ka një pH prej 7, por uji holandez i çezmës zakonisht ka një pH ndërmjet 7.5 dhe 8.3. Uji shumë acid (uji me një vlerë të ulët pH) ka më shumë të ngjarë të shpërndajë kimikate toksike. Këto mund të ndotin ujin dhe ta bëjnë atë të pasigurt për të pirë.
Mësoni pse provojmë pH e ujit. Uji i pastër ka një pH prej 7, por uji holandez i çezmës zakonisht ka një pH ndërmjet 7.5 dhe 8.3. Uji shumë acid (uji me një vlerë të ulët pH) ka më shumë të ngjarë të shpërndajë kimikate toksike. Këto mund të ndotin ujin dhe ta bëjnë atë të pasigurt për të pirë. - Në përgjithësi, këshillohet të testohet pH në vend. Nëse merrni një mostër uji për hulumtime laboratorike, dioksidi i karbonit (CO2) nga ajri mund të tretet në ujë. Dioksidi i karbonit i tretur reagon me jonet në ujë dhe rrit aciditetin në tretësirat themelore ose ato neutrale. Për të shmangur ndotjen e dioksidit të karbonit, uji duhet të testohet brenda dy orësh nga mbledhja.