Autor:
Sara Rhodes
Data E Krijimit:
12 Shkurt 2021
Datën E Azhurnimit:
26 Qershor 2024

Përmbajtje
- Hapa
- Metoda 1 nga 3: Çfarë është pH
- Metoda 2 nga 3: Llogaritni pH nga një përqendrim i njohur
- Metoda 3 nga 3: Llogaritni përqendrimin nga një pH e njohur
- Këshilla
Në jetën e përditshme, pH zakonisht kuptohet si një shkallë e përdorur për të përshkruar neutralitetin ose, anasjelltas, mungesën e neutralitetit të një substance. Në aspektin shkencor, vlera e pH korrespondon me sasinë e joneve në një zgjidhje kimike. Nëse jeni duke studiuar kimi ose lëndë të ngjashme, mund t'ju duhet të llogaritni nivelin e pH bazuar në përqendrimin e substancave në tretësirë. Vlera e pH gjendet duke përdorur formulën e mëposhtme: pH = -lg [H3O].
Hapa
Metoda 1 nga 3: Çfarë është pH
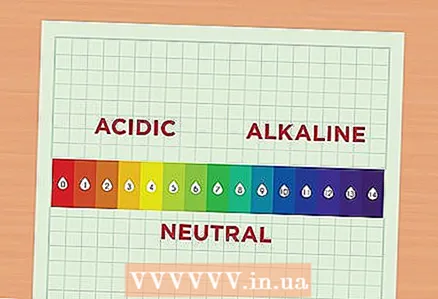 1 Mësoni rreth pH. Vlera e pH korrespondon me përqendrimin e joneve të hidrogjenit në tretësirë. Një zgjidhje me një përqendrim të shtuar të joneve të hidrogjenit quhet acid, dhe një zgjidhje me një përqendrim të zvogëluar të këtyre joneve quhet alkaline. Jonet e hidrogjenit përcaktohen shkurtimisht si H. Ato gjithashtu mund të përfaqësohen si pjesë e një përbërjeje, pastaj quhen hidronium dhe shkruhen si H30.
1 Mësoni rreth pH. Vlera e pH korrespondon me përqendrimin e joneve të hidrogjenit në tretësirë. Një zgjidhje me një përqendrim të shtuar të joneve të hidrogjenit quhet acid, dhe një zgjidhje me një përqendrim të zvogëluar të këtyre joneve quhet alkaline. Jonet e hidrogjenit përcaktohen shkurtimisht si H. Ato gjithashtu mund të përfaqësohen si pjesë e një përbërjeje, pastaj quhen hidronium dhe shkruhen si H30. - Lexoni shkallën e pH. Shkalla e pH varion nga 1 në 14. Sa më i ulët numri, aq më acid është tretësira. Anasjelltas, sa më e lartë vlera, aq më alkaline është zgjidhja. Për shembull, pH i lëngut të portokallit është 2 sepse ky lëng është një lëng mjaft acid. Zbardhuesi i klorit ka një pH prej 12 sepse përmban shumë alkale. Në mes të shkallës janë zgjidhje relativisht neutrale, siç është uji, i cili ka një pH prej 7.
- Një ndryshim 1 pikë midis dy zgjidhjeve në shkallën e pH do të thotë se ato ndryshojnë në aciditet me një faktor 10. Për shembull, nëse merrni dy tretësira me pH 6 dhe 7, aciditeti i tretësirës së parë me pH 6 do të jetë 10 herë më i lartë se aciditeti i tretësirës së dytë me pH 7. Dhe, për shembull, aciditeti i një solucioni me pH 6 është 100 herë më i lartë se aciditeti i një zgjidhjeje me pH 8.
 2 Mësoni përmendësh ekuacionin për përcaktimin e pH. Shkalla e pH llogaritet duke përdorur logaritmin dhjetor negativ. Një logaritm dhjetor negativ korrespondon me numrin e zerove paraardhës, duke përfshirë zero numra të plotë: për shembull, logaritmi dhjetor negativ prej 0.1 është 1, 0.01 është 2, dhe kështu me radhë. Formula për gjetjen e pH është si më poshtë: pH = -lg [H3O].
2 Mësoni përmendësh ekuacionin për përcaktimin e pH. Shkalla e pH llogaritet duke përdorur logaritmin dhjetor negativ. Një logaritm dhjetor negativ korrespondon me numrin e zerove paraardhës, duke përfshirë zero numra të plotë: për shembull, logaritmi dhjetor negativ prej 0.1 është 1, 0.01 është 2, dhe kështu me radhë. Formula për gjetjen e pH është si më poshtë: pH = -lg [H3O]. - Ndonjëherë formula shkruhet si pH = -lg [H]. Nuk ka rëndësi nëse ekuacioni H3O ose H, të dyja janë ekuivalente.
- Nuk është e nevojshme të jeni në gjendje të llogaritni logaritmin dhjetor për të gjetur pH, pasi pothuajse çdo llogaritës shkencor ose inxhinierik ka një mundësi për ta llogaritur atë.
 3 Mësoni rreth përqendrimit. Përqendrimi i një substance i përgjigjet numrit të grimcave të kësaj substance të pranishme në tretësirë. Si rregull, përqendrimi shprehet në numrin e moleve për njësi vëllimi dhe shënohet si m / V, ose M. Në laboratorët kimikë, përqendrimi i zgjidhjeve shkruhet në shishe me to. Nëse jeni duke zgjidhur një problem kimik, përqendrimi mund të jepet në gjendje, ose duhet gjetur.
3 Mësoni rreth përqendrimit. Përqendrimi i një substance i përgjigjet numrit të grimcave të kësaj substance të pranishme në tretësirë. Si rregull, përqendrimi shprehet në numrin e moleve për njësi vëllimi dhe shënohet si m / V, ose M. Në laboratorët kimikë, përqendrimi i zgjidhjeve shkruhet në shishe me to. Nëse jeni duke zgjidhur një problem kimik, përqendrimi mund të jepet në gjendje, ose duhet gjetur.
Metoda 2 nga 3: Llogaritni pH nga një përqendrim i njohur
 1 Mos harroni formulën për gjetjen e pH. Këtu është formula: pH = -lg [H3O]. Sigurohuni që jeni njohur me të gjithë elementët që përbëjnë këtë formulë. Shikoni se çfarë vlere korrespondon me përqendrimin.
1 Mos harroni formulën për gjetjen e pH. Këtu është formula: pH = -lg [H3O]. Sigurohuni që jeni njohur me të gjithë elementët që përbëjnë këtë formulë. Shikoni se çfarë vlere korrespondon me përqendrimin. - Në kimi, kllapat katrore nënkuptojnë përqendrimin e diçkaje.Pra formula për llogaritjen e pH lexon "pH është e barabartë me logaritmin negativ të përqendrimit të jonit hidronium."
 2 Përcaktoni përqendrimin aktual. Lexoni me kujdes deklaratën e problemit. Gjeni përqendrimin e acidit ose alkali në të dhënat burimore. Shkruani formulën e plotë në një copë letër, duke zëvendësuar vlerat e njohura në të. Për të shmangur konfuzionin, gjithmonë tregoni njësitë e matjes pranë numrave.
2 Përcaktoni përqendrimin aktual. Lexoni me kujdes deklaratën e problemit. Gjeni përqendrimin e acidit ose alkali në të dhënat burimore. Shkruani formulën e plotë në një copë letër, duke zëvendësuar vlerat e njohura në të. Për të shmangur konfuzionin, gjithmonë tregoni njësitë e matjes pranë numrave. - Për shembull, nëse përqendrimi është 1.05 x 10 M, shkruani formulën për llogaritjen e pH si më poshtë: pH = -lg [1.05 x 10 M]
 3 Llogarit pH. Convenientshtë i përshtatshëm të përdorni një llogaritës shkencor për këtë. Fillimisht futni shenjën minus duke shtypur butonin "+/-". Pastaj shtypni butonin "log" që korrespondon me logaritmin dhjetor (në anglisht, logaritmi dhjetor quhet log). Ekrani shfaq "-log". Pastaj shtypni kllapën e majtë dhe futni përqendrimin. Mos harroni të tregoni vlerën e gradës nëse është e nevojshme. Pastaj mbyllni kllapat. Si rezultat, do të shihni “-log (1.05x10) në ekranin e kalkulatorit. Klikoni "=". Duhet të keni një vlerë pH prej afërsisht 4.98.
3 Llogarit pH. Convenientshtë i përshtatshëm të përdorni një llogaritës shkencor për këtë. Fillimisht futni shenjën minus duke shtypur butonin "+/-". Pastaj shtypni butonin "log" që korrespondon me logaritmin dhjetor (në anglisht, logaritmi dhjetor quhet log). Ekrani shfaq "-log". Pastaj shtypni kllapën e majtë dhe futni përqendrimin. Mos harroni të tregoni vlerën e gradës nëse është e nevojshme. Pastaj mbyllni kllapat. Si rezultat, do të shihni “-log (1.05x10) në ekranin e kalkulatorit. Klikoni "=". Duhet të keni një vlerë pH prej afërsisht 4.98.
Metoda 3 nga 3: Llogaritni përqendrimin nga një pH e njohur
 1 Përcaktoni se çfarë është dhënë dhe çfarë doni të gjeni. Shkruani formulën për llogaritjen e pH. Pastaj zbuloni vlerat e njohura duke shkruar vlerat e tyre nën formulën. Për shembull, nëse e dini se pH juaj është 10.1, shkruani atë numër nën pH në formulën tuaj.
1 Përcaktoni se çfarë është dhënë dhe çfarë doni të gjeni. Shkruani formulën për llogaritjen e pH. Pastaj zbuloni vlerat e njohura duke shkruar vlerat e tyre nën formulën. Për shembull, nëse e dini se pH juaj është 10.1, shkruani atë numër nën pH në formulën tuaj.  2 Shndërroni formulën. Në këtë rast, do t'ju duhet njohuri nga kursi i algjebrës shkollore. Për të llogaritur përqendrimin nga një vlerë e njohur pH, është e nevojshme të transformohet formula në mënyrë që përqendrimi të qëndrojë larg nga secila anë e ekuacionit. Kjo do të thotë, është e nevojshme që në njërën anë të shenjës së barabartë të ketë një shprehje që përmban vlerën e pH, dhe në anën tjetër - përqendrimi i hidroniumit. Së pari, shumëzoni të dy anët e ekuacionit me -1. Pastaj ngrini 10 në fuqitë në të dyja anët e barazisë që rezulton.
2 Shndërroni formulën. Në këtë rast, do t'ju duhet njohuri nga kursi i algjebrës shkollore. Për të llogaritur përqendrimin nga një vlerë e njohur pH, është e nevojshme të transformohet formula në mënyrë që përqendrimi të qëndrojë larg nga secila anë e ekuacionit. Kjo do të thotë, është e nevojshme që në njërën anë të shenjës së barabartë të ketë një shprehje që përmban vlerën e pH, dhe në anën tjetër - përqendrimi i hidroniumit. Së pari, shumëzoni të dy anët e ekuacionit me -1. Pastaj ngrini 10 në fuqitë në të dyja anët e barazisë që rezulton. - Konvertimi i barazisë pH = -log [H3O], marrim formulën + [H3O] = 10, domethënë, përqendrimi i joneve është dhjetë në fuqinë -pH. Tani, në vend të pH, ne zëvendësojmë një vlerë të njohur, në rastin tonë 10.1.
 3 Zgjidh ekuacionin. Ekziston një procedurë specifike për ngritjen e dhjetë në një fuqi në kalkulator. Lloji i parë 10. Pastaj shtypni tastin e eksponentimit. Vendosni një shenjë minus dhe një vlerë shkalle. Klikoni "=".
3 Zgjidh ekuacionin. Ekziston një procedurë specifike për ngritjen e dhjetë në një fuqi në kalkulator. Lloji i parë 10. Pastaj shtypni tastin e eksponentimit. Vendosni një shenjë minus dhe një vlerë shkalle. Klikoni "=". - Në shembullin tonë, pH është 10.1. Thirrni "10" dhe shtypni butonin "EXP". Pastaj shtypni "- / +", duke ndryshuar shenjën. Së fundi, futni vlerën e pH "10.1" dhe shtypni butonin "=". Si rezultat, duhet të përfundoni me 1e-100. Kjo do të thotë se përqendrimi është 1.00 x 10 M.
 4 Konsideroni përgjigjen që keni marrë. A ka kuptim fizik? Nëse pH është 10.1, kjo do të thotë se përqendrimi i hidroniumit është jashtëzakonisht i ulët dhe ju keni një zgjidhje alkaline. Kështu, përqendrimi i gjetur shumë i ulët korrespondon me
4 Konsideroni përgjigjen që keni marrë. A ka kuptim fizik? Nëse pH është 10.1, kjo do të thotë se përqendrimi i hidroniumit është jashtëzakonisht i ulët dhe ju keni një zgjidhje alkaline. Kështu, përqendrimi i gjetur shumë i ulët korrespondon me
Këshilla
- Nëse llogaritja e nivelit tuaj të pH është e vështirë në fillim, mbani në mend se ka shumë burime për të mësuar më shumë rreth temës. Përdorni një libër shkollor të kimisë ose kërkoni një mësues që t'ju ndihmojë.



